Защитное действие новых производных ГАМК на β-клетки поджелудочной железы в условиях экспериментального сахарного диабета 2 типа
DOI:
https://doi.org/10.18413/rrpharmacology.9.10042Аннотация
Введение: Гамма-аминомасляная кислота (ГАМК) и ГАМК-ергические соединения в последние годы рассматриваются как потенциальные средства для лечения сахарного диабета и его осложнений. Помимо основной тормозной функции в мозге, ГАМК также является сигнальной молекулой в островках поджелудочной железы (ПЖ), оказывая влияние на секрецию инсулина и глюкагона, а также апоптоз, выживаемость бета-клеток и их регенерацию.
Цель: Сравнить защитное действие на β-клетки поджелудочной железы у ГАМК и ее новых производных у животных возрастом 18 месяцев с продолжительным стрептозотоцин-никотинамид-индуцированным сахарным диабетом.
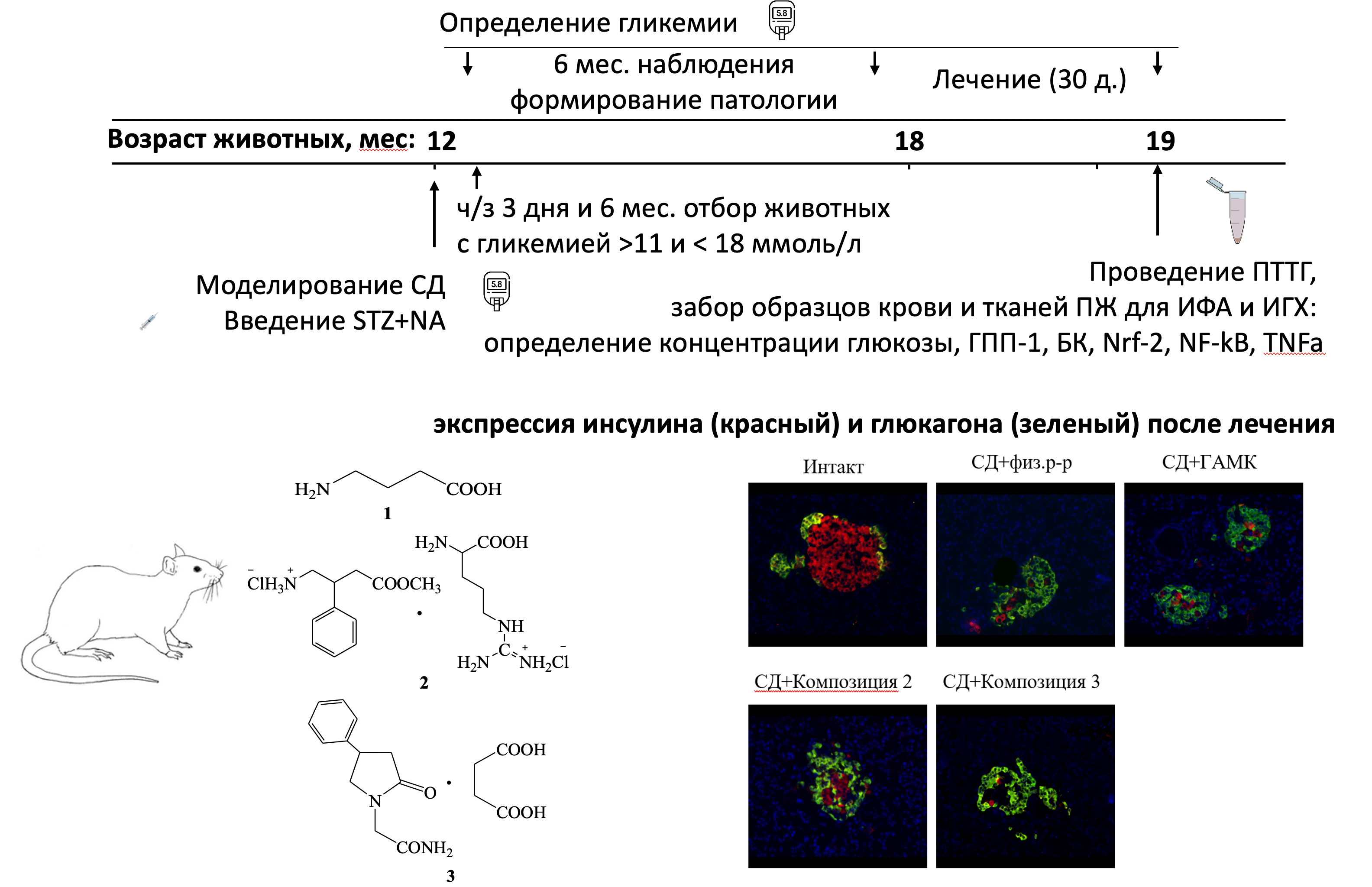
Материалы и методы: Сахарный диабет моделировали белым аутбредным крысам-самцам (12 месяцев) посредством введения комбинации стрептозотоцина (65 мг/кг) и никотинамида (230 мг/кг). В течение последующих 6 месяцев осуществлялся контроль уровня гликемии каждые 4 недели. Далее для исследования были отобраны животные с уровнем постпрандиальной гликемии между 11 и 18 ммоль/л. После формирования групп, в течение 1 месяца животные соответственно получали ГАМК и ГАМК-ергические соединения (композиция 2 и 3), контрольная группа получала физиологический раствор. После лечения был выполнен пероральный тест на толерантность к глюкозе. Далее был произведен забор образцов крови и тканей ПЖ (селезеночная часть) для иммуноферментного анализа (уровень ГПП-1, TNF-α в сыворотке и уровень NF-Κb,Nrf2, Клото в гомогенате ПЖ), иммуногистохимического анализа (экспрессия NF-Κb, Nrf2 и Клото в островках ПЖ) и иммунофлуоресцентного анализа (экспрессия инсулина и глюкагона в островках ПЖ).
Результаты: Результаты исследования подтверждают выраженный гипогликемический эффект изученных производных ГАМК у животных возрастом 18 месяцев с продолжительной гипергликемией. Гипогликемическое действие исследуемых композиций сопровождалось увеличенной продукцией ГПП-1, улучшением функции и массы β-клеток ПЖ. Кроме того, повышенные уровни белка Клото и транскрипционного фактора Nrf2, а также подавление транскрипционного фактора NF-κB после лечения, могут играть ключевую роль в защитном действии исследуемых ГАМК-ергических соединений в отношении β-клеток.
Заключение: Новые производные ГАМК обладают значительным защитным эффектом для β-клеток ПЖ. Эффекты могут быть обусловлены увеличенной на фоне их введения продукцией ГПП-1, белка Клото и транскрипционного фактора Nrf2, а также подавлением транскрипционного фактора NF-κB. Эти результаты подчеркивают потенциал ГАМК-ергических соединений в качестве средств для лечения сахарного диабета и его осложнений.
Графическая аннотация
Ключевые слова:
сахарный диабет, GLP-1, инсулин, белок Клото, NF-κB, Nrf2, стрептозотоцинБиблиографические ссылки
Abraham CR, Li A (2022) Aging-suppressor Klotho: Prospects in diagnostics and therapeutics. Ageing Research Reviews 82: 101766. https://doi.org/10.1016/j.arr.2022.101766 [PubMed]
Adoga JO, Channa ML, Nadar A (2022) Type-2 diabetic rat heart: The effect of kolaviron on mTOR-1, P70S60K, PKC-α, NF-kB, SOD-2, NRF-2, eNOS, AKT-1, ACE, and P38 MAPK gene expression profile. Biomedicine & Pharmacotherapy 148: 112736. https://doi.org/10.1016/j.biopha.2022.112736 [PubMed]
Al-Kuraishy HM, Hussian NR, Al-Naimi MS, Al-Gareeb AI, Al-Mamorri F, Al-Buhadily AK (2021) The potential role of pancreatic γ-aminobutyric acid (GABA) in diabetes mellitus: A critical reappraisal. International Journal of Preventive Medicine 12: 19. https://doi.org/10.4103/ijpvm.IJPVM_278_19 [PubMed] [PMC]
Antoni FA (2022) The case for clinical trials with novel GABAergic drugs in diabetes mellitus and obesity. Life (Basel, Switzerland) 12(2): 322. https://doi.org/10.3390/life12020322 [PubMed] [PMC]
Arrojo e Drigo R (2021) Probing β-Cell biology in space and time. Diabetes 70(10): 2163–2173. https://doi.org/10.2337/dbi21-0008 [PubMed] [PMC]
Dai C, Hang Y, Shostak A, Poffenberger G, Hart N, Prasad N, Phillips N, Levy SE, Greiner DL, Shultz LD, Bottino R, Kim SK, Powers AC (2017) Age-dependent human β cell proliferation induced by glucagon-like peptide 1 and calcineurin signaling. The Journal of Clinical Investigation 127(10): 3835–3844. https://doi.org/10.1172/JCI91761[PubMed] [PMC]
Dedov II, Shestakova MV, Vikulova OK, Zheleznyakova AV, Isakov MA, Sazonova DV, Mokrysheva NG (2023) Diabetes mellitus in the Russian Federation: Dynamics of epidemiological indicators according to the federal register of diabetes mellitus for the period 2010-2022. Diabetes Mellitus [Sakharnyj Diabet] 26(2): 104–123. https://doi.org/10.14341/dm13035 [in Russian]
Donate-Correa J, Martín-Carro B, Cannata-Andía JB, Mora-Fernández C, Navarro-González JF (2023) Klotho, oxidative stress, and mitochondrial damage in kidney disease. Antioxidants (Basel, Switzerland) 12(2): 239. https://doi.org/10.3390/antiox12020239 [PubMed] [PMC]
Gao W, Guo L, Yang Y, Wang Y, Xia S, Gong H, Zhang BK, Yan M (2022) Dissecting the crosstalk between Nrf2 and NF-κB response pathways in drug-induced toxicity. Frontiers in Cell and Developmental Biology 9: 809952. https://doi.org/10.3389/fcell.2021.809952 [PubMed] [PMC]
Indrowati M, Pratiwi R, Rumiyati, Astuti P (2017) Levels of blood glucose and insulin expression of beta-cells in streptozotocin-induced diabetic rats treated with ethanolic extract of artocarpus altilis leaves and GABA. Pakistan Journal of Biological Sciences: PJBS 20(1): 28–35. https://doi.org/10.3923/pjbs.2017.28.35 [PubMed]
Liu W, Son DO, Lau HK, Zhou Y, Prud'homme GJ, Jin T, Wang Q (2017) Combined oral administration of GABA and DPP-4 inhibitor prevents beta cell damage and promotes beta cell regeneration in mice. Frontiers in Pharmacology 8: 362. https://doi.org/10.3389/fphar.2017.00362 [PubMed] [PMC]
Maltese G, Psefteli PM, Rizzo B, Srivastava S, Gnudi L, Mann GE, Siow RC (2017) The anti-ageing hormone klotho induces Nrf2-mediated antioxidant defences in human aortic smooth muscle cells. Journal of Cellular and Molecular Medicine 21(3): 621–627. https://doi.org/10.1111/jcmm.12996 [PubMed] [PMC]
Prud'homme GJ, Glinka Y, Kurt M, Liu W, Wang Q (2017) The anti-aging protein Klotho is induced by GABA therapy and exerts protective and stimulatory effects on pancreatic beta cells. Biochemical and Biophysical Research Communications 493(4): 1542–1547. https://doi.org/10.1016/j.bbrc.2017.10.029 [PubMed]
Prud’homme GJ, Glinka Y, Udovyk O, Hasilo C, Paraskevas S, Wang Q (2014) GABA protects pancreatic beta cells against apoptosis by increasing SIRT1 expression and activity. Biochemical and Biophysical Research Communications 452(3): 649–654. https://doi.org/10.1016/j.bbrc.2014.08.135 [PubMed]
Prud'homme GJ, Kurt M, Wang Q (2022) Pathobiology of the klotho antiaging protein and therapeutic considerations. Frontiers in Aging 3: 931331. https://doi.org/10.3389/fragi.2022.931331 [PubMed] [PMC]
Robertson RP (2023) Nrf2 and antioxidant response in animal models of type 2 diabetes. International Journal of Molecular Sciences 24(4): 3082. https://doi.org/10.3390/ijms24043082 [PubMed] [PMC]
Soltani N, Qiu H, Aleksic M, Glinka Y, Zhao F, Liu R, Li Y, Zhang N, Chakrabarti R, Ng T, Jin T, Zhang H, Lu WY, Feng ZP, Prud’homme GJ, Wang Q (2011) GABA exerts protective and regenerative effects on islet beta cells and reverses diabetes. Proceedings of the National Academy of Sciences of the United States of America 108(28): 11692–11697. https://doi.org/10.1073/pnas.1102715108 [PubMed] [PMC]
Sun H, Saeedi P, Karuranga S, Pinkepank M, Ogurtsova K, Duncan BB, Stein C, Basit A, Chan JCN, Mbanya JC, Pavkov ME, Ramachandaran A, Wild SH, James S, Herman WH, Zhang P, Bommer C, Kuo S, Boyko EJ, Magliano DJ (2022) IDF diabetes atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Research and Clinical Practice 183: 109119. https://doi.org/10.1016/j.diabres.2021.109119 [PubMed]
Typiak M, Piwkowska A (2021) Antiinflammatory actions of klotho: Implications for therapy of diabetic nephropathy. International Journal of Molecular Sciences 22(2): 956. https://doi.org/10.3390/ijms22020956 [PubMed] [PMC]
van der Horst D, Carter-Timofte ME, van Grevenynghe J, Laguette N, Dinkova-Kostova AT, Olagnier D (2022) Regulation of innate immunity by Nrf2. Current Opinion in Immunology 78: 102247. https://doi.org/10.1016/j.coi.2022.102247 [PubMed]
Zubkiewicz-Kucharska A, Wikiera B, Noczyńska A (2021) Soluble klotho is decreased in children with type 1 diabetes and correlated with metabolic control. Frontiers in endocrinology 12: 709564. https://doi.org/10.3389/fendo.2021.709564[PubMed] [PMC]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2023 Иван Н. Тюренков, Дмитрий А. Бакулин, Юлия И. Великородная, Александр В. Борисов, Елизавета А. Абросимова, Алексей В. Смирнов, Григорий Л. Снигур, Святослав С. Сурин, Дарья А. Кавалерова, Ольга С. Васильева

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

