Агонист гетерорецептора EPOR/CD131 оказывает эндотелиопротекторное действие на фоне легочной гипертензии, вызванной монокроталином
DOI:
https://doi.org/10.18413/rrpharmacology.9.10057Аннотация
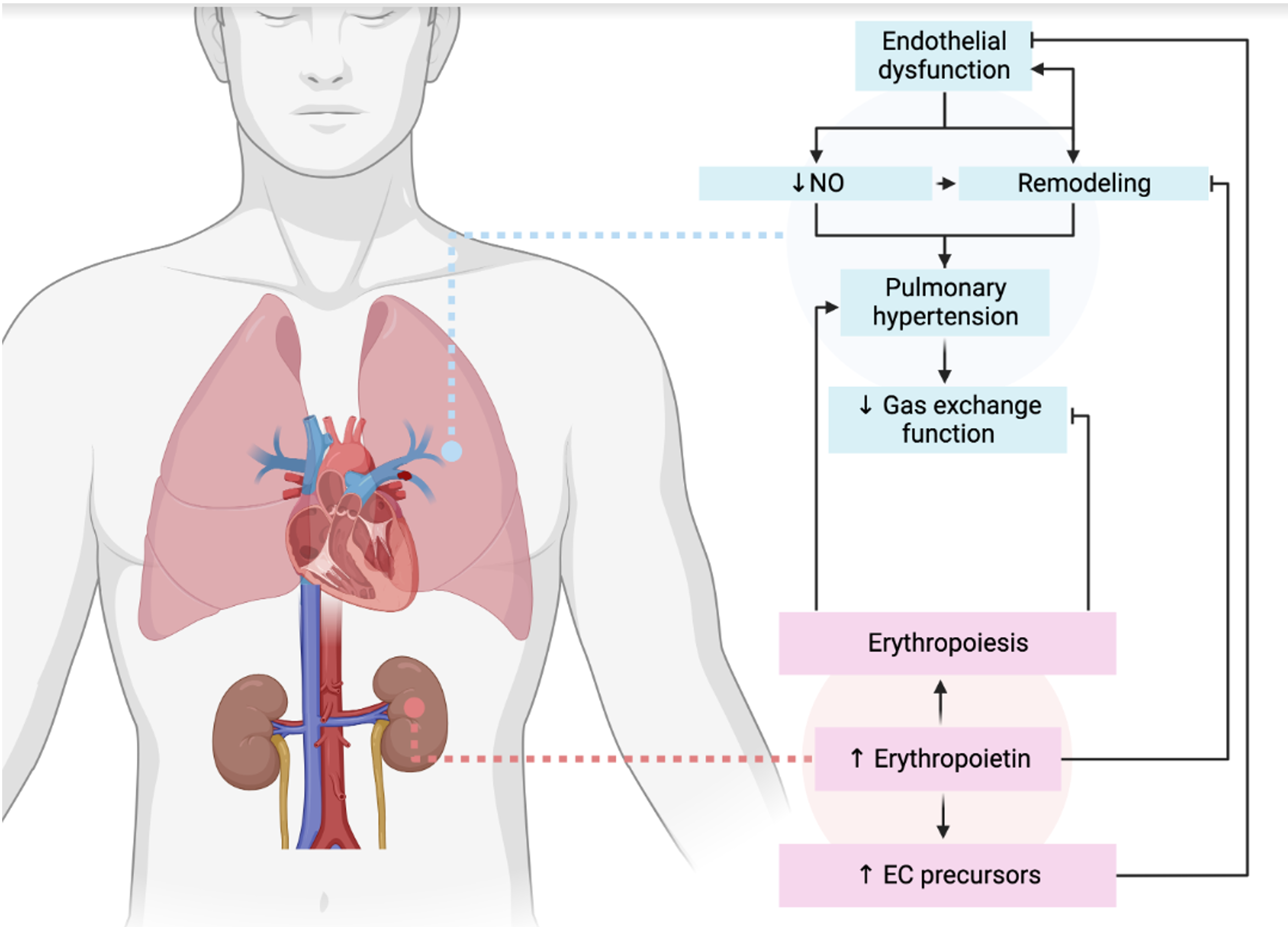
Введение: Аномальное повышение легочного давления, наблюдаемое при легочной артериальной гипертензии (ЛАГ), является следствием повышенного легочного сосудистого сопротивления из-за прогрессирующей потери и облитерации легочных артерий. Первоначальным пусковым механизмом является комбинация факторов, которые приводят к повреждению эндотелия и нарушению регенерации сосудов. Цель: изучить возможности фармакологической коррекции легочной артериальной гипертензии, индуцированной монокроталином, с использованием агониста гетерорецепторов EPOR/CD131 с лабораторным кодом EP-11-3.
Материалы и методы: Изучение фармакологической активности на модели легочной артериальной гипертензии, индуцированной монокроталином, проводилось на крысах-самцах Sprague-Dawley массой 180-220 граммов. Легочную гипертензию моделировали у 30 животных с помощью подкожной инъекции монокроталина (МКТ) в дозе 60 мг/кг. Через семь дней после инъекции МКТ начинали введение исследуемых соединений. Производное эритропоэтина с лабораторным кодом EP-11-3 и pHBSP вводили подкожно в дозе 25 мкг/кг один раз в 3 дня в течение 21 дня.
Результаты: На модели ЛАГ, индуцированной монокроталином, было показано, что производное эритропоэтина с лабораторным кодом EP-11-3 обладает выраженным эндотелиопротекторным действием, снижая коэффициент эндотелиальной дисфункции, статистически значимо повышая экспрессию мРНК VEGF-R2 и снижая экспрессию мРНК SDF-1, снижение концентрации CT-1 и PNP, а также уменьшение признаков ремоделирования сердца и легочных сосудов.
Заключение: Производное эритропоэтина с лабораторным кодом ЕР-11-3 обладает эндотелиопротекторным действием и уменьшает проявления сосудистого ремоделирования при легочной гипертензии, вызванной монокроталином.
Графическая аннотация
Ключевые слова:
Монокроталин, EPOR/CD131, предшественники эндотелиальных клеток, эндотелиопротектор, легочная гипертензияБиблиографические ссылки
Brines M, Patel NS, Villa P, Brines C, Mennini T, De Paola M, Erbayraktar Z, Erbayraktar S, Sepodes B, Thiemermann C, Ghezzi P, Yamin M, Hand CC, Xie QW, Coleman T, Cerami A (2008) Nonerythropoietic, tissue-protective peptides derived from the tertiary structure of erythropoietin. Proceedings of the National Academy of Sciences of the United States of America 105(31): 10925–10930. https://doi.org/10.1073/pnas.0805594105 [PubMed] [PMC]
Golubev IV, Gureev VV, Korokin MV, Zatolokina MA, Avdeeva EV, Gureeva AV, Rozhkov IS, Serdyuk EA, Soldatova VA (2020) Preclinical study of innovative peptides mimicking the tertiary structure of the α-helix B of erythropoietin. Research Results in Pharmacology 6(2): 85–96. https://doi.org/10.3897/rrpharmacology.6.55385
Ikarashi N, Toba K, Kato K, Ozawa T, Oda M, Takayama T, Kobayashi H, Yanagawa T, Hanawa H, Suzuki T, Nakazawa M, Nomoto M, Asami F, Higuchi M, Saito H, Aizawa Y (2012) Erythropoietin, but not asialoerythropoietin or carbamyl-erythropoietin, attenuates monocrotaline-induced pulmonary hypertension in rats. Clinical and Experimental Hypertension 34(8): 575–581.https://doi.org/10.3109/10641963.2012.681728 [PubMed]
Karamanian VA, Harhay M, Grant GR, Palevsky HI, Grizzle WE, Zamanian RT, Ihida-Stansbury K, Taichman DB, Kawut SM, Jones PL (2014) Erythropoietin upregulation in pulmonary arterial hypertension. Pulmonary Circulation 4(2): 269–279. https://doi.org/10.1086 /675990 [PubMed] [PMC]
Kurakula K, Smolders VFED, Tura-Ceide O, Jukema JW, Quax PHA, Goumans MJ (2021) Endothelial dysfunction in pulmonary hypertension: Cause or consequence? Biomedicines 9(1): 57. https://doi.org/10.3390/biomedicines9010057 [PubMed] [PMC]
Kuzubova EV, Radchenko AI, Pokrovsky VM (2022) Pathological conditions associated with tau protein: mechanisms of development and possible biological targets for pharmacological correction of tau proteinopathy (review). Research Results in Biomedicine 8(4): 474–494. https://doi.org/10.18413/2658-6533-2022-8-4-0-5
McLaughlin VV, Archer SL, Badesch DB, Barst RJ, Farber HW, Lindner JR, Mathier MA, McGoon MD, Park MH, Rosenson RS, Rubin LJ, Tapson VF, Varga J (2009) ACCF/AHA 2009 expert consensus document on pulmonary hypertension a report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association developed in collaboration with the American College of Chest Physicians; American Thoracic Society, Inc.; and the Pulmonary Hypertension Association. Journal of the American College of Cardiology 53(17): 1573–1619. https://doi.org/10.1161/CIRCULATIONAHA.109.192230[PubMed]
Peng B, Kong G, Yang C, Ming Y (2020) Erythropoietin and its derivatives: from tissue protection to immune regulation. Cell Death & Disease 11(2): 79. https://doi.org/10.1038/s41419-020-2276-8 [PubMed] [PMC]
Pompilio G, Capogrossi MC, Pesce M, Alamanni F, DiCampli C, Achilli F, Germani A, Biglioli P (2009) Endothelial progenitor cells and cardiovascular homeostasis: clinical implications. International Journal of Cardiology 131(2): 156–167. https://doi.org/10.1016/j.ijcard.2008.08.033 [PubMed]
Puchenkova OA, Nadezhdin SV, Soldatov VO (2020) Study of antiatherosclerotic and endothelioprotective activity of peptide agonists of epor/cd131 heteroreceptor. Pharmacy & Pharmacology 8(2): 100–111. https://doi.org/10.19163/2307-9266-2020-8-2-100-111
Ranchoux B, Harvey LD, Ayon RJ, Babicheva A, Bonnet S, Chan SY, Yuan JX, Perez VJ (2018) Endothelial dysfunction in pulmonary arterial hypertension: an evolving landscape. Pulmonary Circulation 8(1): 2045893217752912. https://doi.org/10.1177/2045893217752912 [PubMed] [PMC]
Rubin LJ (2006) Pulmonary arterial hypertension. Proceedings of the American Thoracic Society 3(1): 111–115. https://doi.org/10.1513/pats.200510-112JH [PubMed]
Satoh K, Kagaya Y, Nakano M, Ito Y, Ohta J, Tada H, Karibe A, Minegishi N, Suzuki N, Yamamoto M, Ono M, Watanabe J, Shirato K, Ishii N, Sugamura K, Shimokawa H (2006) Important role of endogenous erythropoietin system in recruitment of endothelial progenitor cells in hypoxia-induced pulmonary hypertension in mice. Circulation 113(11): 1442–1450.https://doi.org/1Q19x3wmkRsfrHjcC5MuLgjGds733ApvwS [PubMed]
Urakami T, Järvinen TA, Toba M, Sawada J, Ambalavanan N, Mann D, McMurtry I, Oka M, Ruoslahti E, Komatsu M (2011) Peptide-directed highly selective targeting of pulmonary arterial hypertension. The American Journal of Pathology 178(6): 2489–2495. https://doi.org/10.1016/j.ajpath.2011.02.032 [PubMed] [PMC]
van Loon RL, Bartelds B, Wagener FA, Affara N, Mohaupt S, Wijnberg H, Pennings SW, Takens J, Berger RM (2015) Pulmonary vascular remodeling in experimental pulmonary arterial hypertension through interplay between endothelial progenitor cells and heme oxygenase. Frontiers in Pediatrics 3: 71. https://doi.org/10.3389/fped.2015.00071 [PubMed] [PMC]
YanYun P, Wang S, Yang J, Chen B, Sun Z, Ye L, Zhu J, Wang X (2015) Interruption of CD40 Pathway improves efficacy of transplanted endothelial progenitor cells in monocrotaline induced pulmonary arterial hypertension. Cellular Physiology and Biochemistry 36(2): 683–696. https://doi.org/ 10.1159/000430130 [PubMed]
Zagrebelnaya AV, Korokina LV, Malorodova TN, Shcheblykina OV, Avtina TV, Bolgov AА, Malyutina ES, Simonov VI, Travkin VA, Dmitriev AА, Aripov AA, Shcheblykin DV (2023) Pulmonary hypertension: modern methods of treatment and ways of their long-term development. Research Results in Pharmacology 9(2): 37–54. https://doi.org/10.18413/rrpharmacology.9.10026
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2023 Lilia V. Korokina

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

