Эффективность соединения, содержащего остаток аскорбиновой кислоты при ишемическом повреждении головного мозга
DOI:
https://doi.org/10.18413/rrpharmacology.10.508Аннотация
Введение: ишемическое повреждение головного мозга (ГМ) сохраняет лидирующие позиции по частоте инвалидизации и уровню летальности в мире. Защита клеточной популяции в условиях прекращения поступления кислорода и нутриентов – ключевой фактор, определяющий как медицинские, так и социальные последствия при своевременном применении терапевтических стратегий. Цель исследования: изучить антиишемическую активность аскорбината 3-гидроксипиридина на in vitro и in vivo моделях, воспроизводящих ответ клеток и тканей головного мозга на ишемию и реоксигенацию.
Материалы и методы: изучено соединение 3-гидроксипиридина аскорбинат (лабораторный шифр 3-EA) в виде фармацевтической субстанции с чистотой 99,8%. Рабочий раствор готовили при растворении субстанции в забуференном изотоническом 0,9% растворе хорида натрия. Внутриклеточная концентрация Ca2+ в ответ на глутаматергическую эксайтотоксичность (GluTox), ишемию и реоксигенацию, а также выживаемость клеток оценены в живой свежей нейроглиальной кортикальной культуре NMRI мышей. Культуру клеток инкубировали в присутствии 3-EA с последующей регистрацией флюоресценции Fura-2 и пропидия иодида. Экспрессию генов-регуляторов апоптоза BCL-2, STAT3, SOCS3, генов-регуляторов воспаления TRAIL, MLKL, Cas-1, Cas-3, IL-1β и TNFα, генов MAO-A и MAO-B определяли ПЦР в режиме реального времени. Нейропротекторная активность субстанции в дозе 18 мг/кг изучена на самцах крыс Sprague-Dawley с интралюминальной окклюзией/реперфузией средней мозговой артерии (СМА) с помощью регистрации неврологического дефицита и морфологических изменений срезов ГМ.
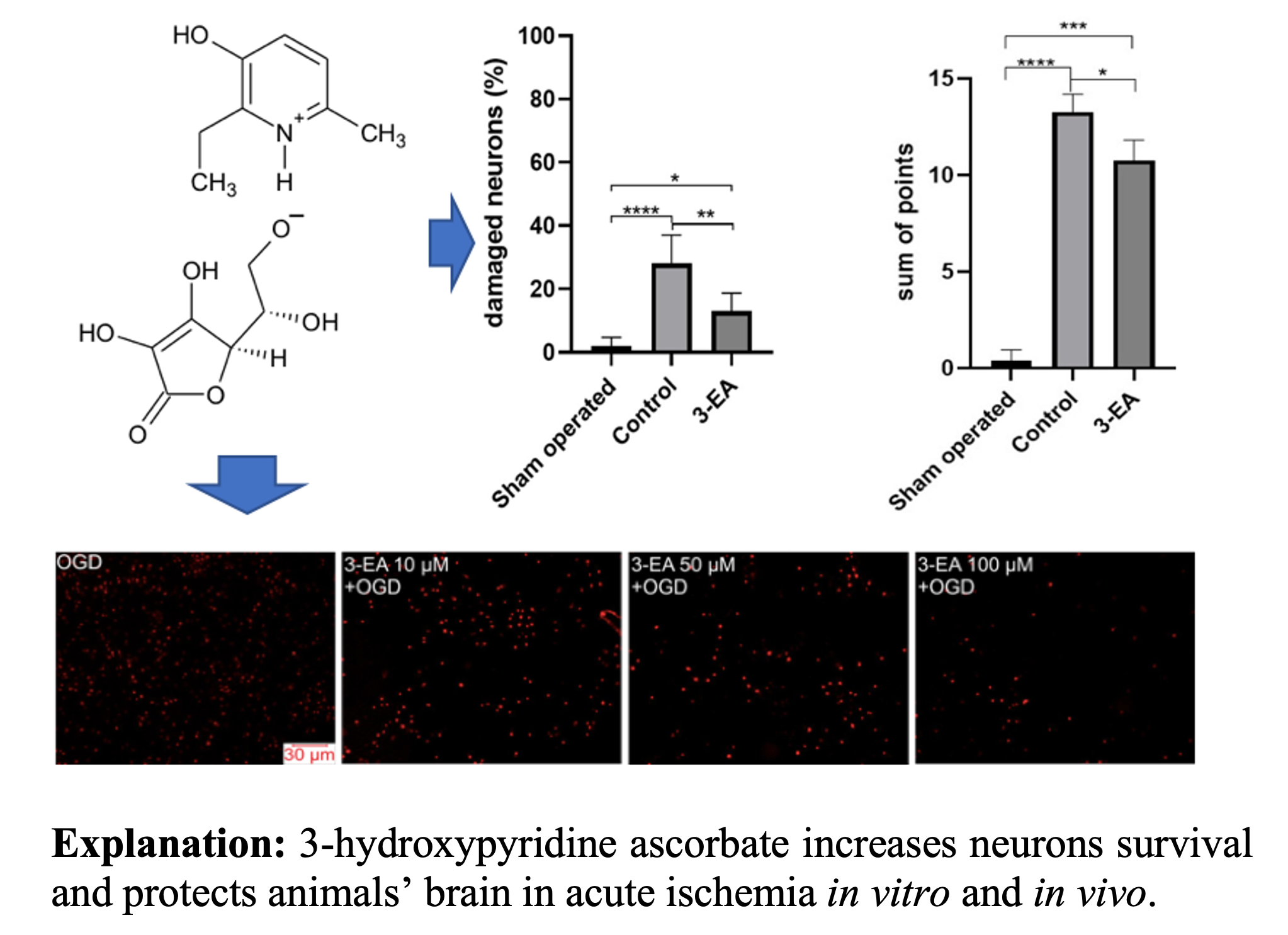
Результаты: Преинкубация кортикальных клеток в присутствии 10-100 мкM 3-EA ведет к снижению [Ca2+]i в цитозоле нейронов и глиальных клеток как на фоне GluTox, так и при моделировании глюкозо-кислородной депривации (OGD). Подавление [Ca2+]i сопровождается повышением выживаемости клеток культуры в остром эксперименте. Воздействие 3-EA сопровождается повышением экспрессии антиапоптотических генов BCL-2,STAT3, SOCS3 на фоне подавления экспрессии генов TRAIL, MLKL, Cas-1, Cas-3, IL-1β и TNFα. Внутрибрюшинное введение 3-EA снижает объем некротической области в ГМ лабораторных крыс, уменьшает размер перинекротического отека, глубину клеточных повреждений и неврологического дефицита у крыс с окклюзией СМА.
Выводы: 3-EA в зависимости от концентрации повышает выживаемость кортикальных клеток на фоне глутаматергической эксайтотоксичности и острой ишемии/реоксигенации. Цитопротекторный эффект 3-EAвключает изменения базальной и индуцированной экспрессии генов – регуляторов апоптоза и воспаления, что приводит к необратимому подавлению программируемой гибели клеток на поздних стадиях. Курсовое введение 3-ЕА лабораторным животным сопровождается снижением глубины и тяжести ишемического поражения ГМ вследствие сохранения популяции функционально-активных нейронов в зоне пенумбры.
Графическая аннотация
Ключевые слова:
аскорбат гидроксипиридина (3-EA), ишемия, повреждение головного мозга, клеточная культура, эксайтотоксичность,, Ca2 , окклюзия мозговой артерии, неврологический дефицитБиблиографические ссылки
Bailey EL, Smith C, Sudlow CL, Wardlaw JM (2012) Pathology of lacunar ischemic stroke in humans –a systematic review. Brain Pathology22(5): 583–591.https://doi.org/10.1111/j.1750-3639.2012.00575.x [PubMed]
Balch MHH, Nimjee SM, Rink C, Hannawi Y (2020) Beyond the brain: The systemic pathophysiological response to acute ischemic stroke. Journal of Stroke 22(2): 159–172. https://doi.org/10.5853/jos.2019.02978 [PubMed]
Bederson JB, Pitts LH, Tsuji M, Nishimura MC, Davis RL, Bartkowski H (1986) Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination. Stroke 1986 17(3): 472–476. https://doi.org/10.1161/01.str.17.3.472[PubMed]
Benjamin EJ, Blaha MJ, Chiuve SE, Cushman M, Das SR, Deo R et al.(2017) Heart disease and stroke statistics-2017 update: A report from the American Heart Association. Circulation135(10): e146–e603. https://doi.org/10.1161/cir.0000000000000491 [PubMed]
Blinova E, Turovsky E, Eliseikina E, Igrunkova A, Semeleva E, Golodnev G, Termulaeva R, Vasilkina O, Skachilova S, Mazov Y, Zhandarov K, Simakina E, Belanov K, Zalogin S, Blinov D (2022). Novel hydroxypyridine compound protects brain cells against ischemic damage in vitro and in vivo. International Journal of Molecular Sciences 23(21): 12953. https://doi.org/10.3390/ijms232112953 [PubMed]
Chen YC, Ma NX, Pei ZF, Wu Z, Do-Monte FH, Keefe S, Yellin E, Chen MS, Yin JC, Lee G, Minier-Toribio A, Hu Y, Bai YT, Lee K, Quirk GJ, Chen G (2020). A neuroD1 AAV-based gene therapy for functional brain repair after ischemic injury through in vivo astrocyte-to-neuron conversion. Molecular Therapy28(1): 217–234. https://doi.org/10.1016/j.ymthe.2019.09.003 [PubMed]
GBD 2015 Mortality and Causes of Death Collaborators Global, regional, and national life expectancy, all-cause mortality, and cause-specific mortality for 249 causes of death, 1980-2015: A systematic analysis for the Global Burden of Disease Study 2015 (2016).Lancet 388(10053): 1459–1544. https://doi.org/10.1016/s0140-6736(14)61682-2 [PubMed]
Katan M and Luft A (2018). Global burden of stroke. Seminars in Neurology 38(2): 208–211 (2018). https://doi.org/10.1055/s-0038-1649503 [PubMed]
Mirzoyan RS, Gan’shina TS, Kurdyumov IN, Maslennikov DV, Gnezdilova AV, Gorbunov AA, Kurza EV, Turilova AI, Kostochka LM, Mirzoyan NR (2021) Migraine pharmacology and brain ischemia. Research Results in Pharmacology7(2): 67–82. https://doi.org/10.3897/rrpharmacology.7.67463
Ren X, Hu H, Farooqi I, Simpkins JW (2020).Blood substitution therapy rescues the brain of mice from ischemic damage. Nature Communications11(1): 4078. https://doi.org/10.1038/s41467-020-17930-x [PubMed]
Turovsky EA, Varlamova EG, Gudkov SV, Plotnikov EY (2021) The protective mechanism of deuterated linoleic acid involves the activation of the Ca2+ signaling system of astrocytes in ischemia in vitro. International Journal of Molecular Sciences 22(24): 13216. https://doi.org/10.3390/ijms222413216 [PubMed]
Varlamova EG, Turovsky EA, Babenko EY, Plotnikov EY (2021). The mechanisms underlying the protective action of selenium nanoparticles against ischemia/reoxygenation are mediated by the activation of the Ca2+ signaling system of astrocytes and reactive astrogliosis. International Journal of Molecular Sciences 22(23): 12825. https://doi.org/10.3390/ijms222312825 [PubMed] [PubMed]
Warlow C, Sudlow C, Dennis M, Wardlaw J, Sandercock P (2003) Stroke. Lancet 362(9391): 1211–1224. https://doi.org/10.1016/S0140-6736(03)14544-8 [PubMed]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2024 Rita M. Termulaeva, Konstantin Y. Belanov, Natalya D. Bunyatyan, Aleksander S. Pirozhkov, Dmitrii E. Timoshkin, Ekaterina V. Blinova, Olga V. Vasilkina, Kirill D. Blinov; Elena V. Semeleva; Aleksander A. Dmitriev, Dmitrii S. Blinov

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

