Исследование противопаркинсонической активности новых производных имидазол-4,5-дикарбоновой кислоты на экспериментальной модели каталепсии
DOI:
https://doi.org/10.18413/rrpharmacology.9.10006Аннотация
Введение. Изучить противопаркинсоническую активность новых лигандов рецепторного комплекса глутамата NMDA – 1,2-замещенных имидазол-4,5-дикарбоновых кислот – на экспериментальной модели каталепсии, вызванной интраабдоминальным введением галоперидола крысам.
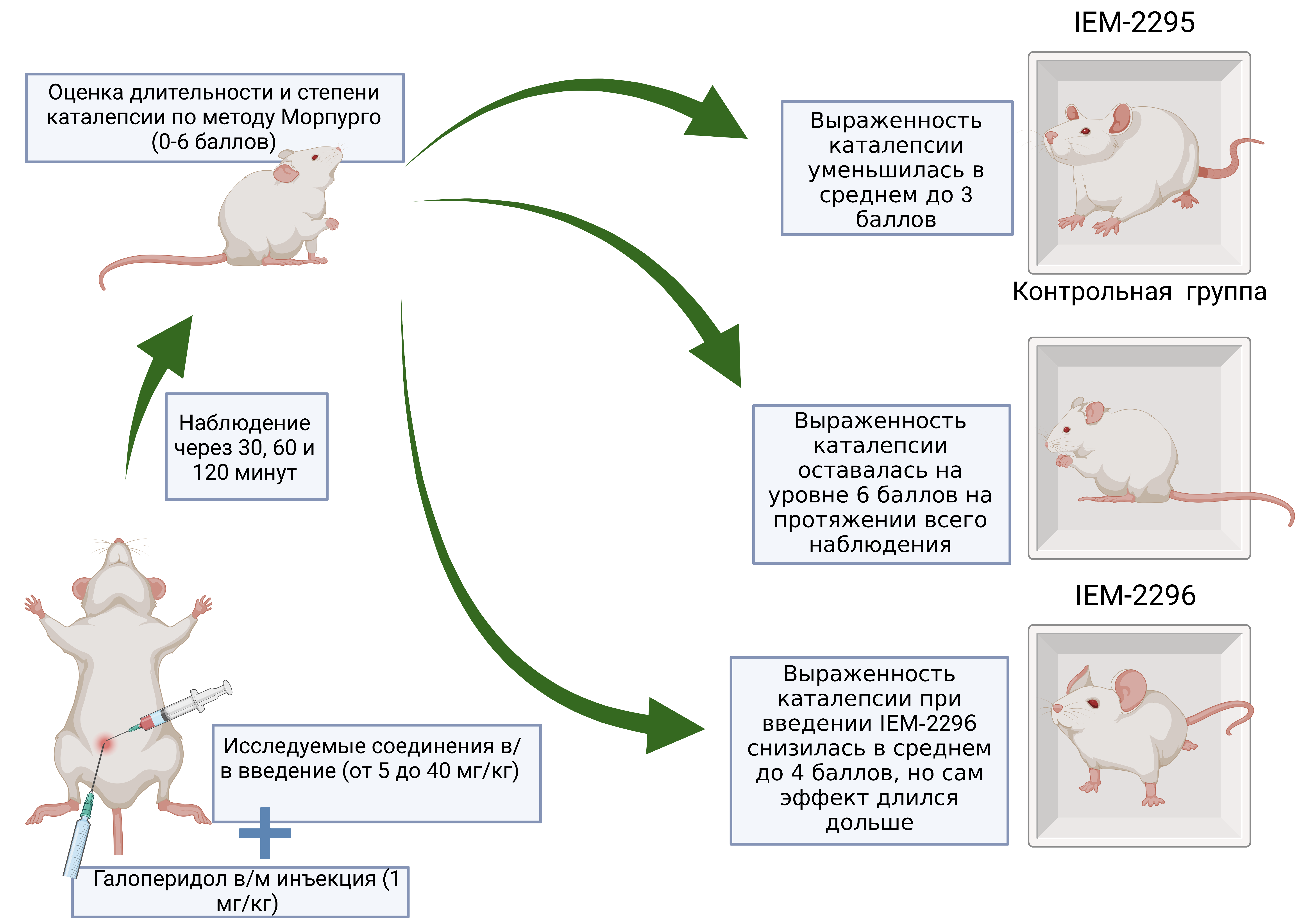
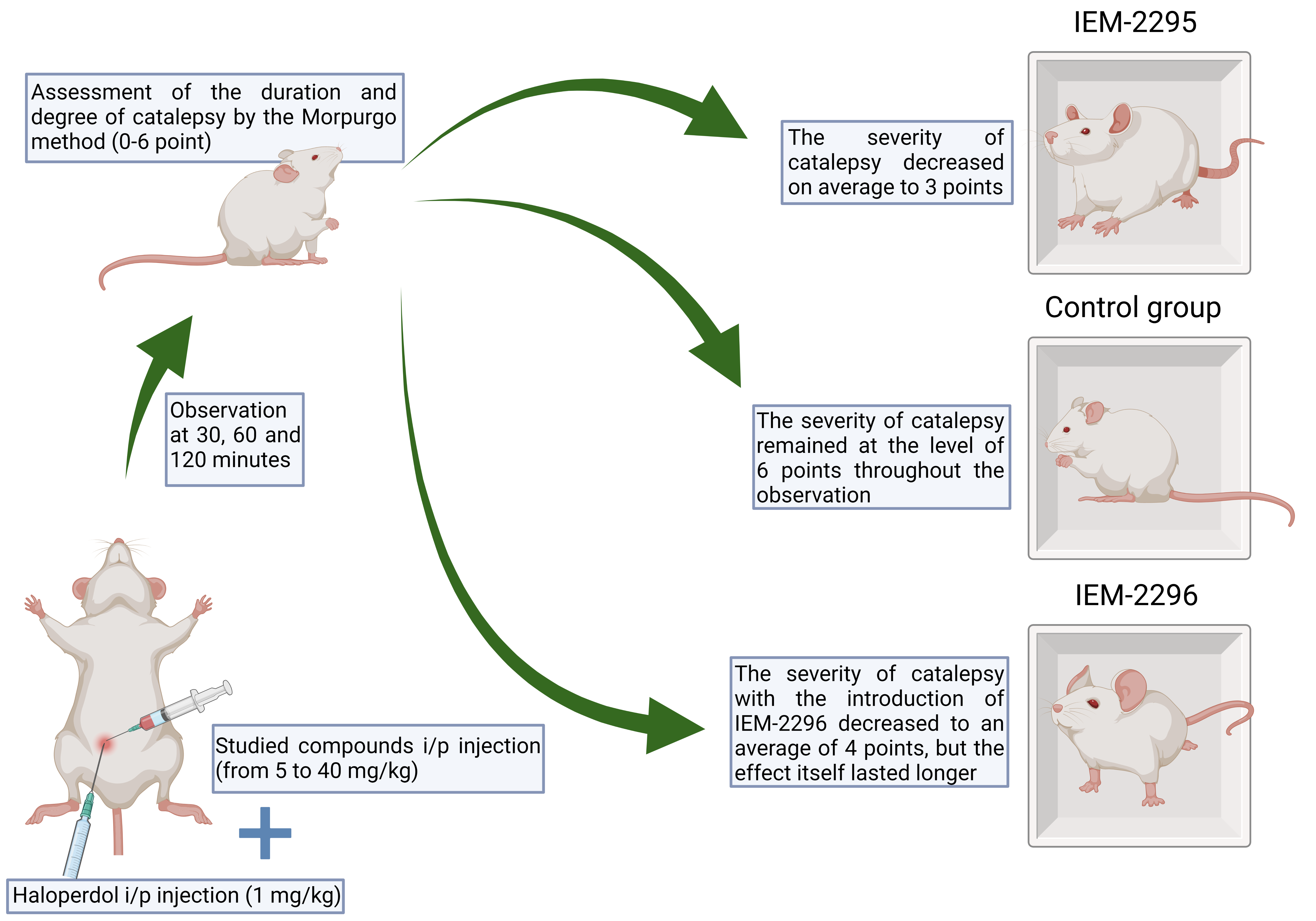
Материалы и методы. Опыты выполнены на крысах линии Вистар массой 300-350 г, полученных из питомника "Рапполово" РАМН (Ленинградская область). Животные содержались в стандартных пластиковых клетках в условиях вивария при свободном доступе к воде и корму при температуре 22±2 °С и в ходе эксперимента были разделены на несколько групп (по 6 животных в каждой). Все опыты проводились в осенне-зимний период. Животных содержали в соответствии с правилами лабораторной практики (GLP), нормативными документами «Санитарные правила устройства, оборудования и содержания вивария» и Приказом Минздравсоцразвития РФ от 23.08.2010 г. № 708н «Об утверждении Правил лабораторной практики». Производные имидазол-дикарбоновой кислоты (IEM-2295, IEM-2296) вводили внутрибрюшинно в дозах от 5 мг/кг до 40 мг/кг одновременно с галоперидолом в дозе 1 мг/кг, после чего определяли продолжительность и выраженность каталепсии, оценку проводили через 30, 60, 120 минут по бальной системе - от 0 до 6 баллов по методу Морпурго.
Результаты. Выраженность каталепсии при введении IEM-2295 снизилась в среднем до 3 баллов, в то время как в контрольной группе сохранялась на уровне 6 баллов на протяжении всего наблюдения. Однако выраженность каталепсии при введении IEM-2296 снижалась в среднем до 4 баллов, но сам эффект сохранялся дольше, чем при введении IEM-2295. Так, отмечено, что к 120-й минуте наблюдения выраженность каталепсии у крыс, получавших соединение IEM-2295, составляла в среднем 5 баллов, тогда как у животных, получавших IEM-2296, – 3 балла.
Обсуждение. На основании результатов нашей работы и аналогичных экспериментов можно сделать вывод, что исследуемые соединения, не являющиеся блокаторами каналов, оказывают активное влияние на дофаминергическую нейротрансмиссию, из-за чего симптомы каталепсии, возникающие при введении крысам галоперидола, были остановлены в той или иной степени.
Заключение. Исследуемые вещества проявляют антипаркинсоническую активность на экспериментальной галоперидоловой модели каталепсии у крыс и перспективны для разработки в качестве потенциальной терапии нейродегенеративных заболеваний. Требуется дальнейшее изучение этих соединений и других лигандов из группы NMDA-блокаторов на более широкой выборке на модели каталепсии, а также на других моделях паркинсонизма.
Графическая аннотация
Графическая аннотация
Ключевые слова:
Антагонисты NMDA-рецепторов, галоперидол, дофамин, паркинсонизмБиблиографические ссылки
Aradi SD, Hauser RA (2020) Medical management and prevention of motor complications in Parkinson’s disease. Neurotherapeutics 17(4): 1339–1365. https://doi.org/10.1007/s13311-020-00889-4 [PubMed] [PMC]
Bhattacharya S, Ma Y, Dunn AR, Bradner JM, Scimemi A, Miller GW, Traynelis SF, Wichmann T (2018) NMDA receptor blockade ameliorates abnormalities of spike firing of subthalamic nucleus neurons in a parkinsonian nonhuman primate. Journal of Neuroscience Research 96(7): 1324–1335. https://doi.org/10.1002/jnr.24230 [PubMed] [PMC]
Cárcel L, De la Casa LG (2021) Temporal factors modulate haloperidol-induced conditioned catalepsy. Frontiers in Behavioral Neuroscience 15: 713512. https://doi.org/10.3389/fnbeh.2021.713512 [PubMed] [PMC]
Chia SJ, Tan E-K, Chao Y-X (2020) Historical perspective: Models of Parkinson’s disease. International Journal of Molecular Sciences 21(7): 2464. https://doi.org/10.3390/ijms21072464 [PubMed] [PMC]
Chou KL, Stacy M, Simuni T, Miyasaki J, Oertel WH, Sethi K, Fernandez HH, Stocchi F (2018) The spectrum of “off” in Parkinson’s disease: What have we learned over 40 years? Parkinsonism & Related Disorders 51: 9–16. https://doi.org/10.1016/j.parkreldis.2018.02.001 [PubMed]
Christoffersen CL, Meltzer LT (1995) Evidence for N-methyl-d-aspartate and AMPA subtypes of the glutamate receptor on substantia nigra dopamine neurons: Possible preferential role for N-methyl-d-aspartate receptors. Neuroscience 67(2): 373–381. https://doi.org/10.1016/0306-4522(95)00047-M [PubMed]
Cieślik P, Woźniak M, Tokarski K, Kusek M, Pilc A, Płoska A, Radulska A, Pelikant-Małecka I, Żołnowska B, Sławiński J, Kalinowski L, Wierońska JM (2019) Simultaneous activation of muscarinic and GABAB receptors as a bidirectional target for novel antipsychotics. Behavioural Brain Research 359: 671–685. https://doi.org/10.1016/j.bbr.2018.09.019 [PubMed]
Danysz W, Parsons CG, Kornhuber J, Schmidt WJ, Quack G (1997) Aminoadamantanes as NMDA receptor antagonists and antiparkinsonian agents – preclinical studies. Neuroscience & Biobehavioral Reviews 21(4): 455–468. https://doi.org/10.1016/S0149-7634(96)00037-1 [PubMed]
Dergachev VD, Yakovleva EE, Brusina MA, Bychkov ER, Piotrovskiy LB, Shabanov PD (2021) Antiparkinsonian activity of new N-methyl-D-aspartate receptor ligands in the arecoline hyperkinesis test. Medical Council [Meditsinskiy Sovet] 12: 406–412. https://doi.org/10.21518/2079-701X-2021-12-406-412
Draoui A, El Hiba O, Aimrane A, El Khiat A, Gamrani H (2020) Parkinson’s disease: From bench to bedside. Revue Neurologique 176(7-8): 543–559. https://doi.org/10.1016/j.neurol.2019.11.002 [PubMed]
Rascol O, Negre-Pages L, Damier P, Delval A, Derkinderen P, Destée A, Fabbri M, Meissner WG, Rachdi A, Tison F, Perez-Lloret S; COPARK Study Group (2020) Utilization patterns of amantadine in parkinson’s disease patients enrolled in the french COPARK study. Drugs & Aging 37(3): 215–223. https://doi.org/10.1007/s40266-019-00740-2 [PubMed]
Fox SH, Katzenschlager R, Lim S-Y, Barton B, de Bie RMA, Seppi K, Coelho M, Sampaio C, on behalf of the Movement Disorder Society Evidence-Based Medicine Committee (2018) International Parkinson and movement disorder society evidence-based medicine review: Update on treatments for the motor symptoms of Parkinson’s disease. Movement Disorders 33(8): 1248–1266. https://doi.org/10.1002/mds.27372 [PubMed]
Groc L, Choquet D (2020) Linking glutamate receptor movements and synapse function. Science 368(6496): eaay4631. https://doi.org/10.1126/science.aay4631 [PubMed]
Haas KT, Compans B, Letellier M, Bartol TM, Grillo-Bosch D, Sejnowski TJ, Sainlos M, Choquet D, Thoumine O, Hosy E (2018) Pre-post synaptic alignment through neuroligin-1 tunes synaptic transmission efficiency. eLife 7: e31755. https://doi.org/10.7554/eLife.31755 [PubMed] [PMC]
Iakovleva EE, Brusina MA, Bychkov ER, Piotrovsky LB, Shabanov PD (2020) Antiparkinsonian activity of new ligands of the glutamate NMDA-receptor complex – imidazole-4,5-dicarboxylic acid derivatives. Bulletin of the Smolensk State Medical Academy [Vestnik Smolenskoi Gosudarstvennoi Meditsinskoi Akademii] 19: 41–47. https://doi.org/10.37903/vsgma.2020.3.5 [in Russian]
Jankovic J, Tan EK (2020) Parkinson’s disease: etiopathogenesis and treatment. Journal of Neurology, Neurosurgery & Psychiatry 91(8): 795–808. https://doi.org/10.1136/jnnp-2019-322338 [PubMed]
Kabra A, Baghel US, Hano C, Martins N, Khalid M, Sharma R (2020) Neuroprotective potential of Myrica esulenta in Haloperidol induced Parkinson’s disease. Journal of Ayurveda and Integrative Medicine 11(4): 448–454. https://doi.org/10.1016/j.jaim.2020.06.007 [PubMed] [PMC]
Kulisevsky J, Oliveira L, Fox SH (2018) Update in therapeutic strategies for Parkinson’s disease. Current Opinion in Neurology 31(4): 439–447. https://doi.org/10.1097/WCO.0000000000000579 [PubMed]
Li B-D, Bi Z-Y, Liu J-F, Si W-J, Shi Q-Q, Xue L-P, Bai J (2017) Adverse effects produced by different drugs used in the treatment of Parkinson’s disease: A mixed treatment comparison. CNS Neuroscience & Therapeutics 23(10): 827–842. https://doi.org/10.1111/cns.12727 [PubMed] [PMC]
Mellone M, Gardoni F (2018) Glutamatergic mechanisms in l-DOPA-induced dyskinesia and therapeutic implications. Journal of Neural Transmission 125(8): 1225–1236. https://doi.org/10.1007/s00702-018-1846-8 [PubMed]
Mironov AN, Bunjatjan ND, Vasil’ev AN, Verstakova OL, Zhuravleva MV, Lepakhin VK (2012) Vol. 1 Guidelines for conducting preclinical research of medicines. Moscow: Grif and K, 944 pp. [in Russian]
Mironova YuS, Zhukova NG, Zhukova IA, Alifirova VM, Izhboldina OP, Latypova AV (2018) Parkinson’s disease and glutamatergic system. Korsakov Journal of Neurology and Psychiatry [Zhurnal Nevrologii i Psikhiatrii im. S.S. Korsakova] 118: 138. https://doi.org/10.17116/jnevro201811851138 [in Russian]
Müller T, Kuhn W, Möhr J-D (2019) Evaluating ADS5102 (amantadine) for the treatment of Parkinson’s disease patients with dyskinesia. Expert Opinion on Pharmacotherapy 20(10): 1181–1187. https://doi.org/10.1080/14656566.2019.1612365 [PubMed]
Nuzzo T, Punzo D, Devoto P, Rosini E, Paciotti S, Sacchi S, Li Q, Thiolat M-L, Véga C, Carella M, Carta M, Gardoni F, Calabresi P, Pollegioni L, Bezard E, Parnetti L, Errico F, Usiello A (2019) The levels of the NMDA receptor co-agonist D-serine are reduced in the substantia nigra of MPTP-lesioned macaques and in the cerebrospinal fluid of Parkinson’s disease patients. Scientific Reports 9(1): 8898. https://doi.org/10.1038/s41598-019-45419-1 [PubMed] [PMC]
Perez-Lloret S, Rascol O (2018) Efficacy and safety of amantadine for the treatment of l-DOPA-induced dyskinesia. Journal of Neural Transmission 125(8): 1237–1250. https://doi.org/10.1007/s00702-018-1869-1 [PubMed]
Poewe W, Seppi K, Tanner CM, Halliday GM, Brundin P, Volkmann J, Schrag A-E, Lang AE (2017) Parkinson's disease. Nature Reviews Disease Primers 3: 17013. https://doi.org/10.1038/nrdp.2017.13 [PubMed]
Ramírez-Jarquín UN, Shahani N, Pryor W, Usiello A, Subramaniam S (2020) The mammalian target of rapamycin (mTOR) kinase mediates haloperidol-induced cataleptic behavior. Translational Psychiatry 10(1): 336. https://doi.org/10.1038/s41398-020-01014-x [PubMed] [PMC]
Schwab RS (1969) Amantadine in the treatment of Parkinson’s disease. JAMA: The Journal of the American Medical Association 208(7): 1168. https://doi.org/10.1001/jama.1969.03160070046011 [PubMed]
Standaert DG, Testa CM, Young AB, Penney JB (1994) Organization of N-methyl-D-aspartate glutamate receptor gene expression in the basal ganglia of the rat. The Journal of Comparative Neurology 343(1): 1–16. https://doi.org/10.1002/cne.903430102 [PubMed]
Szydlowska K, Tymianski M (2010) Calcium, ischemia and excitotoxicity. Cell Calcium 47(2): 122–129. https://doi.org/10.1016/j.ceca.2010.01.003 [PubMed]
Tarakad A (2020) Clinical rating scales and quantitative assessments of movement disorders. Neurologic Clinics 38(2): 231–254. https://doi.org/10.1016/j.ncl.2019.12.001 [PubMed]
Ugale V, Dhote A, Narwade R, Khadse S, Reddy PN, Shirkhedkar A (2021) GluN2B/N-methyl-D-aspartate receptor antagonists: advances in design, synthesis, and pharmacological evaluation studies. CNS & Neurological Disorders – Drug Targets 20(9): 822–862. https://doi.org/10.2174/1871527320666210309141627 [PubMed]
Vanle B, Olcott W, Jimenez J, Bashmi L, Danovitch I, IsHak WW (2018) NMDA antagonists for treating the non-motor symptoms in Parkinson’s disease. Translational Psychiatry 8(1): 117. https://doi.org/10.1038/s41398-018-0162-2[PubMed] [PMC]
Vecchia DD, Kanazawa LKS, Wendler E, Hocayen P de AS, Vital MABF, Takahashi RN, Da Cunha C, Miyoshi E, Andreatini R (2021) Ketamine reversed short-term memory impairment and depressive-like behavior in animal model of Parkinson’s disease. Brain Research Bulletin 168: 63–73. https://doi.org/10.1016/j.brainresbull.2020.12.011 [PubMed]
Vieira M, Yong XLH, Roche KW, Anggono V (2020) Regulation of NMDA glutamate receptor functions by the GluN2 subunits. Journal of Neurochemistry 154(2): 121–143. https://doi.org/10.1111/jnc.14970 [PubMed] [PMC]
Wang R, Reddy PH (2017) Role of glutamate and NMDA receptors in Alzheimer’s disease. Journal of Alzheimer’s Disease 57(4): 1041–1048. https://doi.org/10.3233/JAD-160763 [PubMed] [PMC]
Wolosker H, Balu DT, Coyle JT (2016) The rise and fall of the d-serine-mediated gliotransmission hypothesis. Trends in Neurosciences 39(11): 712–721. https://doi.org/10.1016/j.tins.2016.09.007 [PubMed] [PMC]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2023 Research Results in Pharmacology

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

