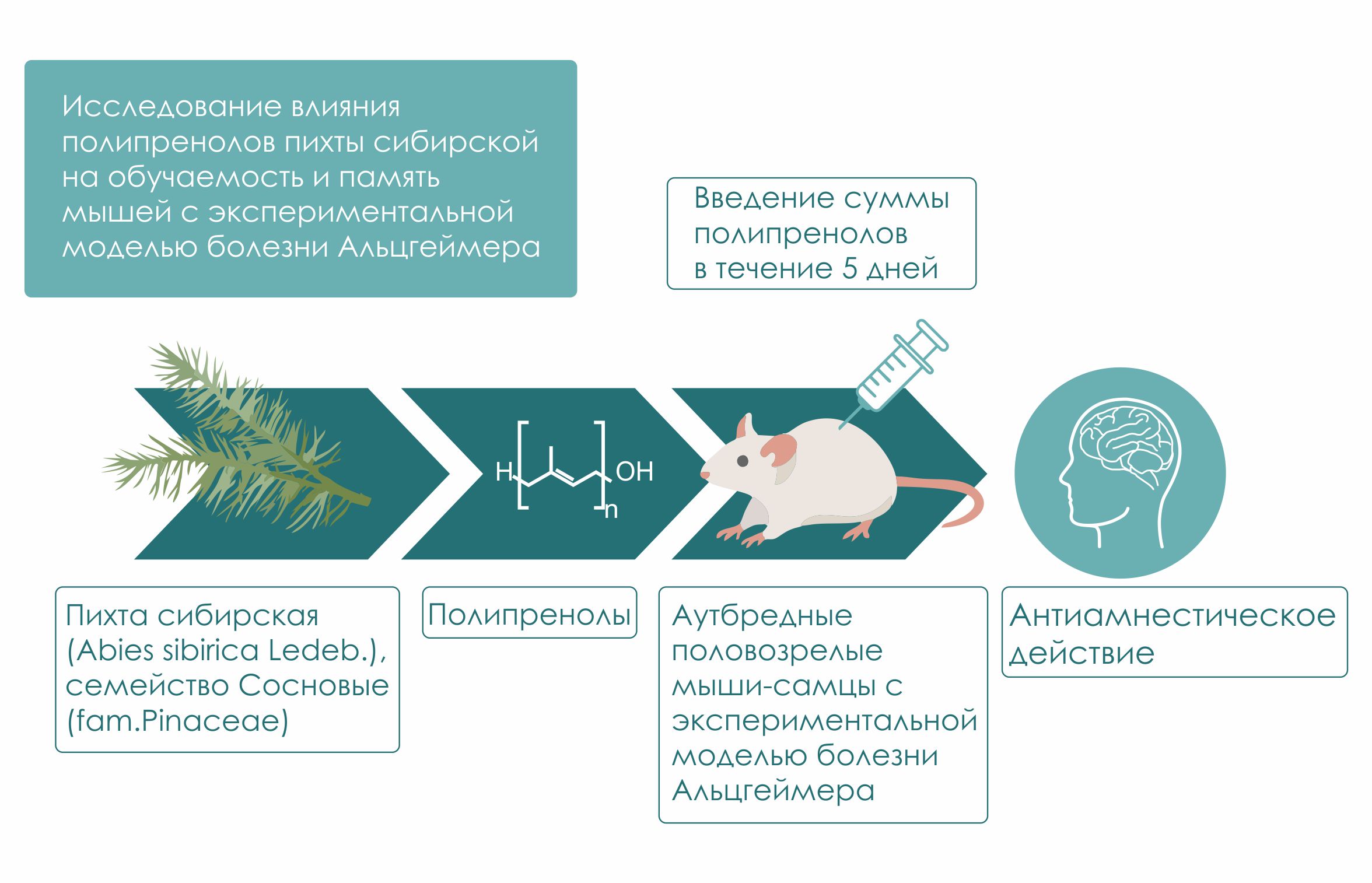
Исследование влияния полипренолов пихты сибирской на обучаемость и память мышей с экспериментальной моделью болезни Альцгеймера
DOI:
https://doi.org/10.18413/rrpharmacology.10.489Аннотация
Введение. Болезнь Альцгеймера все чаще становится причиной ранней инвалидизацией и смерти. Попытки создания фармакотерапевтического средства, дающего эффективный результат в лечении этой патологии, до сегодняшнего дня не увенчались успехом. В данной статье приведены результаты экспериментальных исследований, ставящие целью создание более эффективного средства лечения данного заболевания.
Материалы и методы. Объектом исследования явились полипренолы, выделенные из пихты сибирской (Abiessibirica Ledeb.). Эксперименты выполнены на 108 аутбредных половозрелых мышах-самцах стока СDI массой тела 28 – 30г (в возрасте 5 недель). Эффект суммы полипренолов на обучаемость и память исследовался в интервале доз – 5, 20, 50, 100, 200 и 500 мг/кг массы тела мыши. В качестве препарата сравнения использовали глиатилин в дозе 90 мг/кг. Экспериментальная модель нарушения когнитивных функций создавалась хроническим (в течение 20 дней) внутрибрюшинным введением скополамина в дозе 2 мг/кг. Нарушение когнитивных функций оценивались по изменениям показателей выработки и воспроизведения условного рефлекса пассивного избегания (УРПИ).
Результаты и их обсуждение. Результаты проведенных экспериментов показали, что хроническое введение скополамина вызвало выраженное снижение воспроизводимости УРПИ. Одновременно с этим изучаемая субстанция в дозах 20 и 50 мг/кг. Глиатилин оказывал близкое по характеру действие. Авторы полагают что в развитии антиамнестического эффекта участвуют холинергические рецепторы.
Заключение. Приведенное доклиническое исследование показывает, что найдено новое средство с антиамнестическим действием на основе суммы полипренолов Пихты сибирской (Abies sibirica Ledeb.), семейство Сосновые (fam. Pinaceae). Данное средство может быть использовано для лечения заболеваний нейродегенеративных патологических процессов, в частности болезни Альцгеймера.
Графическая аннотация
Ключевые слова:
Пихта сибирская, полипренолы, деменция, нейродегенеративные заболевания, терапия нарушений когнитивных функций, улучшение памяти, болезнь АльцгеймераБиблиографические ссылки
Beckdash RA (2021) The cholinergic system, the adrenergic system and the neuropathology of alzheimer's disease. International Journal of Molecular Sciences 22(3): 1273. htpps://doi.org/103390/ ijms22031273
Buresh Ya, Bureshova O, Houston JP (1991) Methods and Basic Experiments in the Study of the Brain and Behavior. Higher School Publishing House, Moscow, 398 pp. [in Russian]
Companys-Alemany J, Turcu AL, Vázquez S, Pallàs M, Griñán-Ferré C (2022) Glial cell reactivity and oxidative stress prevention in Alzheimer’s disease mice model by an optimized NMDA receptor antagonist. Scientific Reports 12(1): 17908. https://doi.org/10.1038/s41598-022-22963-x [PubMed] [PMC]
Mironov AN (2012) Guidelines for the Conduct of Preclinical Studies of Medicinal Products. Part one. Griffin and K, Moscow, 291 pp. [in Russian]
Hampel H, Mesulam MM, Cuello AC, Farlow MR, Giacobini E, Grossberg GT, Khachaturian AS, Vergallo A, Cavedo E, Snyder PJ, Khachaturian ZS (2018) The Cholinergic system in the pathophysiology and treatment of Alzheimer’s disease. Brain 141(7): 1917. https://doi.org/10.1093/brain/awy132 [PubMed] [PMC]
Kim HM, Kang SH, Cho S-W, Kang BS (2017) Effects of choline alfoscerate and memantine on memory improvement of scopolamine-induced memory impairment animal model of Alzheimer’s disease. Yakhak Hoeji 61(6): 292. https://doi.org/10.17480/psk.2017.61.6.292
Kenakin T (2008) Overview of receptor interactions of agonists and antagonists. Current Protocols in Pharmacology. 4: Unit 4.1. https://doi.org/10.1002/0471141755.ph0401s42[PubMed]
Huang LK, Kuan YC, Lin HW, Hu CJ (2023) Clinical trials of new drugs for Alzheimer disease: A 2020-2023 update. Journal of Biomedical Science 30(1): 83. https://doi.org/10.1186/s12929-023-00976-6 [PubMed] [PMC]
Liu J, Chang L, Song Y, Li H, Wu Y (2019) The Role of NMDA receptors in Alzheimer’s disease. Frontiers in Neuroscience 13: 43. https://doi.org/10.3389/fnins.2019.00043 [PubMed] [PMC]
Pfundstein G, Nikonenko AG, Sytnyk V (2022) Amyloid precursor protein (APP) and amyloid β (Aβ) interact with cell adhesion molecules: Implication in Alzheimer’s disease and normal physiology. Frontiers in Cell and Developmental Biology 10: 969547. https://doi.org/10:3389/fcell.2022.969547 [PubMed] [PMC]
Shi M, Chu F, Zhu F, Zhu J (2022) Impact of anti-amyloid-β monoclonal antibodies on the pathology and clinical profile of Alzheimer's disease: a focus on aducanumab and lecanemab. Frontiers in Aging Neuroscience. 14: 870517. https://doi.org/10.3389/fnagi.2022.870517[PubMed] [PMC]
Tyuvina NA, Balabanova VV (2015) Treatment of Alzheimer's disease. Neurology, Neuropsychiatry, Psychosomatics 7(3): 80. https://dx.doi.org/10.14412/2074-2711-2015-3-80-85 [in Russian]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2024 Николай И. Суслов, Юлия С. Федорова, Максим Л. Коробов

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

