Влияние циклофосфамида на регуляцию сокращений сердца натрий - кальциевой системой
DOI:
https://doi.org/10.18413/rrpharmacology.11.539Аннотация
Введение: Ежегодно медицина обогащается новыми лекарственными средствами, способными замедлять или останавливать рост злокачественных клеток. К сожалению, имея преимущество в противоопухолевой активности, по сравнению с другими, новые препараты обладают рядом побочных свойств, которые снижают терапевтические возможности лекарства.
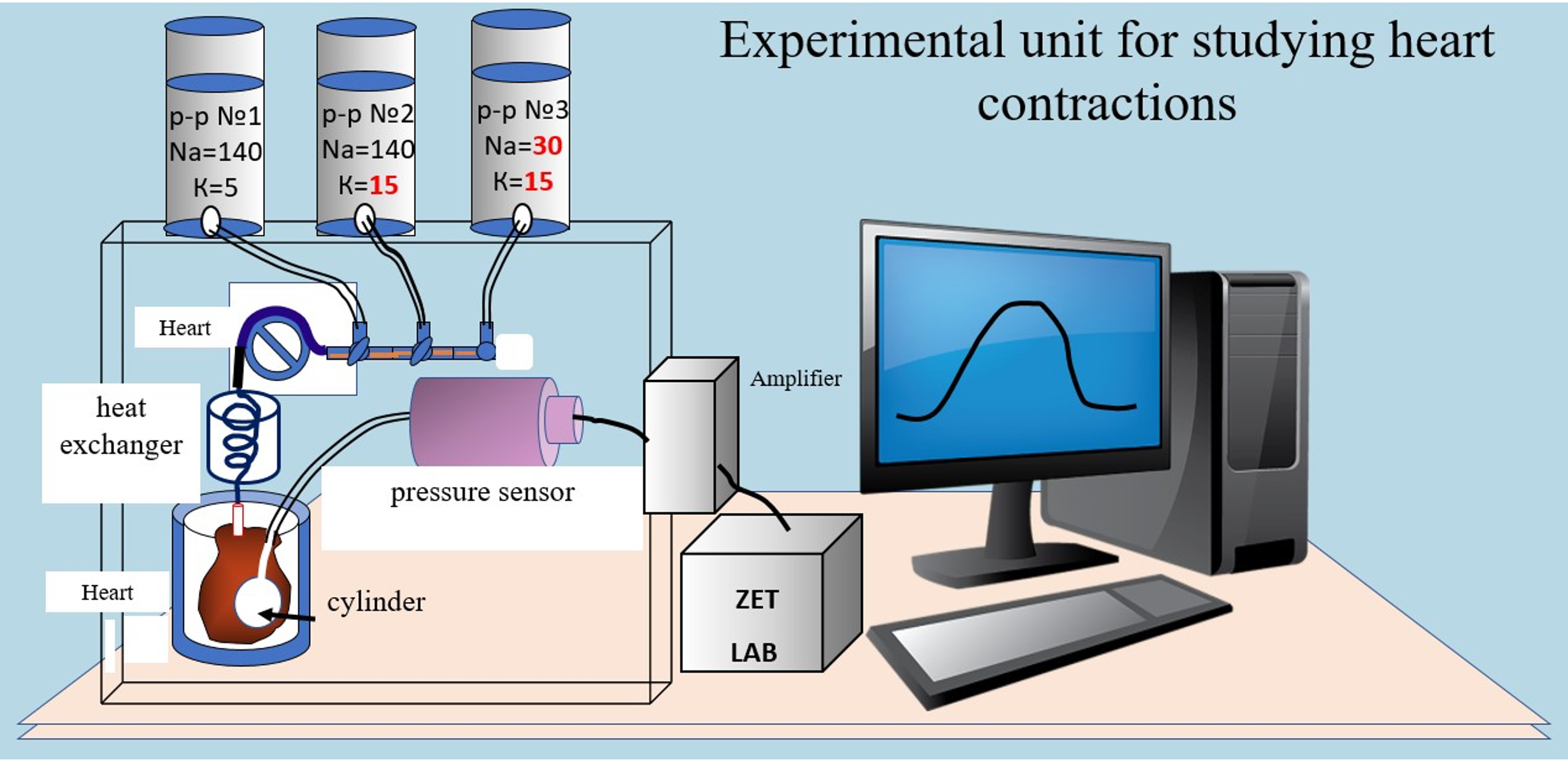
Материалы и методы: Исследование было проведено в трех сериях экспериментов на 24 белых крысах линии Wistar, обоего пола, каждая массой 200-250 г. Под эфирным наркозом производили декапитацию животного с быстрым извлечением сердца и перфузией по методу Лангендорфа. Для исследования состояния Nа-Ca обмена в сердце использовали перфузионное устройство, создающее постоянный коронарный проток. Контроль физиологического состояния сердца при изменениях состава растворов осуществляли с помощью баллончика, введенным в левый желудочек. Сокращения и расслабления сердца регистрировали с помощью электронного датчика давления. Параметры документировались и обрабатывались посредством программного обеспечения внешнего модуля «Zet Lab».
Результаты и их обсуждение: В первой серии опытов изучали влияние гипонатриевого раствора на состояние тонуса левого желудочка сердца, остановленного гиперкалиевой средой. Разработанная методика, послужила основой для изучения влияния циклофосфамида на Nа-Са обмен, сопровождаемый сокращением и расслаблением сердца. Опыты показали на способность циклофосфамида значительно снижать, скорость нарастания тонуса, развитие силы сокращения, а также удлинять время расслабления во время Nа-Са обмена.
Заключение: Циклофосфамид способен нарушать захват ионизированного кальция в цитозоле внутриклеточными Са-аккумулирующими структурами при расслаблении сердца. В отличие от контрольных записей, в присутствии циклофосфамида, повторные расслабления происходят не до конца. В результате, каждое последующее сокращение начинается на более высоком исходном уровне диастолы.
Графическая аннотация
Ключевые слова:
Nа-Са обмен, медленные кальциевые каналы, саркоплазматический ретикулум, циклофосфамид, сокращения изолированного сердца крысыБиблиографические ссылки
Abulfadl Ya, Abo El Ela Y, Alkhaiyat A, Elkhodary I (2023) Cyclophosphamide enfeebles myocardial isometric contraction force via RIP1/RIP3/MLKL/TRPM7-mediated necroptosis. Biomedicine & Pharmacother 163: 114819. https://doi.org/10.1016/j.biopha.2023.114819[PubMed]
Al-Khannaq M, Lytton J (2022) Regulation of K+-dependent Na+/Ca2+-exchangers (NCKX). International Journal of Molecular Sciences 24(1): 598. https://doi.org/10.3390/ijms24010598[PubMed] [PMC]
Bomfim G, Mitaishvili E, Schnetkamp P, Lacruz R (2024) Na+/Ca2+ exchange in enamel cells is dominated by the K+-dependent NCKX exchanger. The Journal of General Physiology 156(1): e202313372. https://doi.org/10.1085/jgp.202313372 [PubMed] [PMC]
Ferreira de Souza T, Quinaglia T, Neilan T, Coelho-Filho O (2019) Assessment of cardiotoxicity of cancer chemotherapy: The value of cardiac MR imaging. Magnetic Resonance Imaging Clinics of North America 27(3): 533–544. https://doi.org/10.1016/j.mric.2019.04.001 [PubMed] [PMC]
Flenner F, Arlt N, Nasib M, Schobesberger S, Koch Th, Ravens U, Friedrich F, Nikolaev V, Christ T, Stehr S (2018) In vitro negative inotropic effect of low concentrations of bupivacaine relates to diminished Ca2+ sensitivity but not to Ca2+ handling or β-adrenoceptor signaling. Anesthesiology 128(6): 1175–1186. https://doi.org/10.1097/ALN.0000000000002180 [PubMed]
Frolova OG, Gladchenko MP, Artyushkova EB, Khvostovoy VV, Kolesnikova AM, Anurova EV, Chernyatina MA (2020) Experimental substantiation of promising ways to reduce the cardiotoxicity of cyclophosphamide using an immobilized form of cyclophosphamide and a cytoprotector. Modern Problems of Science and Education [Sovremennye Problemy Nauki i Obrazovaniya] 5. https://doi.org/10.17513/spno.30087 [in Russian]
Gorvin C (2019) Molecular and clinical insights from studies of calcium-sensing receptor mutations. Journal of Molecular Endocrinology 63(2): R1–R16. https://doi.org/10.1530/JME-19-0104 [PubMed]
Hilgemann D (2020) Control of cardiac contraction by sodium: Promises, reckonings, and new beginnings. Cell Calcium 85: 102129. https://doi.org/10.1016/j.ceca.2019.102129 [PubMed] [PMC]
Liu Ch-H, Chen Z, Oliva M, Luo J, Collier S, Montell C, Hardie R (2020) Rapid Release of Ca2+ from endoplasmic reticulum mediated by Na+/Ca2+ exchange. The Journal of Neuroscience 40(16): 3152–3164. https://doi.org/10.1523/JNEUROSCI.2675-19.2020 [PubMed] [PMC]
Mourouzis I, Kounatidis D, Brozou V, Anagnostopoulos D, Katsaouni A, Lourbopoulos A, Pantos C (2023) Effects of T3 administration on ex vivo rat hearts subjected to normothermic perfusion: Therapeutic implications in donor heart preservation and repair. Transplant International 36: 10742. https://doi.org/10.3389/ti.2023.10742 [PubMed] [PMC]
O'Donnell P, Jones R (2023) The development of post-transplant cyclophosphamide: Half a century of translational team science. Blood Review 62: 101034. https://doi.org/10.1016/j.blre.2022.101034 [PubMed] [PMC]
O'Halloran D (2020) Simulation model of CA1 pyramidal neurons reveal opposing roles for the Na+/Ca2+ exchange current and Ca2+-activated K+ current during spike-timing dependent synaptic plasticity. Plos One 15(3): e0230327. https://doi.org/10.1371/journal.pone.0230327[PubMed] [PMC]
Taslimi P, Kandemir F, Demir Y, İleritürk M, Temel Y, Caglayan C, Gulçin İ (2019) The antidiabetic and anticholinergic effects of chrysin on cyclophosphamide-induced multiple organ toxicity in rats: Pharmacological evaluation of some metabolic enzyme activities. Journal of Biochemical and Molecular Toxicology 33(6): e22313. https://doi.org/10.1002/jbt.22313 [PubMed]
Xue J, Zeng W, Han Y, John S, Ottolia M, Jiang Y (2023) Structural mechanisms of the human cardiac sodium-calcium exchanger NCX1. Nature Communications 14(1): 6181.https://doi.org/10.1038/s41467-023-41885-4 [PubMed] [PMC]
Yue X, Hazan A, Lotteau S, Zhang R, Torrente A, Philipson K, Ottolia M, Joshua I (2020) Goldhaber Na/Ca exchange in the atrium: Role in sinoatrial node pacemaking and excitation-contraction coupling. Cell Calcium 87: 102167. https://doi.org/10.1016/j.ceca.2020.102167[PubMed] [PMC]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2025 Татьяна А. Бережнова, Иван П. Мошуров, Ян Баофен, Чаоцянь Сюй; Ирина В. Коваленко; Владимир В. Алабовский, Алексей А. Винокуров, Олег В. Маслов, Яна В. Кулинцова

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

