Мыши с гиперэкспрессией мутантного белка FUS[1-359] в гомозиготном состоянии: новые перспективы лечения БАС
DOI:
https://doi.org/10.18413/rrpharmacology.10.554Аннотация
Аннотация: В данной работе исследуется модель мышей с гиперэкспрессией мутантного белка FUS[1-359], которая может быть использована для оценки эффективности генной терапии и других фармакологических вмешательств при боковом амиотрофическом склерозе (БАС). Модель позволяет углубить понимание механизмов прогрессии патогенеза заболевания и тестировать новые терапевтические стратегии.
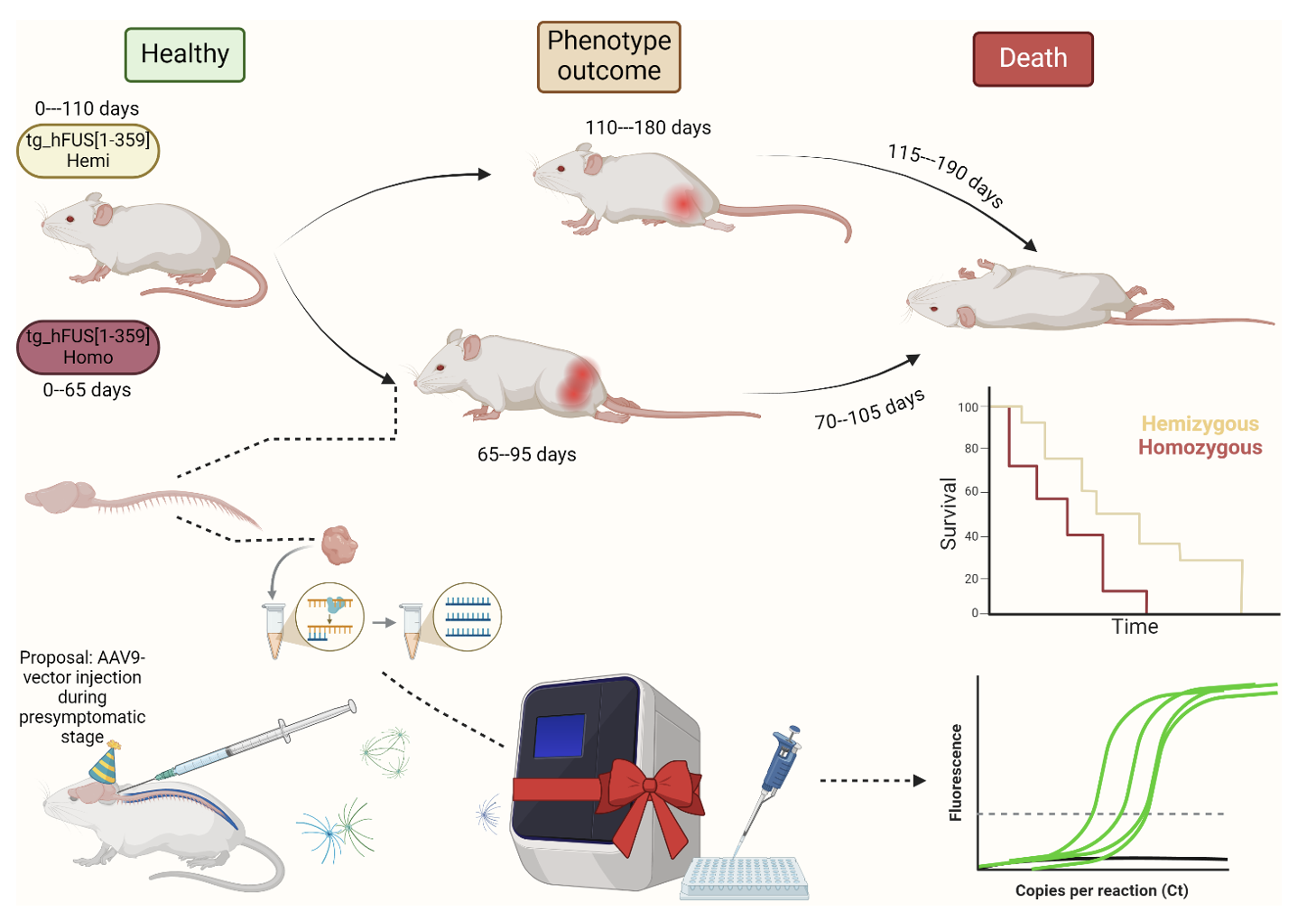
Материалы и методы: В исследовании использовались животные линии tg_hFUS[1-359] с трансгенной кассетой, экспрессирующей человеческий мутантный белок FUS[1-359]. Группы животных были сформированы путем скрещивания гемизиготных особей, и проводился анализ продолжительности жизни, возраста манифестации заболевания, а также относительного количества копий и уровня экспрессии трансгенной кассеты.
Результаты и обсуждения: Результаты показали статистически значимые различия значений возрастов появления первых признаков заболевания между гомозиготными и гемизиготными мышами. Также выявлены различия в копийности трансгенной вставки и выявлено, что у гомозиготных животных наблюдается повышенная экспрессия мутантного белка FUS в различных структурах центральной нервной системы, что согласуется с литературными данными о патогенезе БАС.
Заключение: Мыши с гиперэкспрессией мутантного белка FUS[1-359] представляют собой перспективную генетическую модель для оценки терапевтических подходов к лечению БАС. Данная модель демонстрирует четкие фенотипические проявления заболевания и может быть использована для исследования генотерапевтических методов лечения.
Графическая аннотация
Ключевые слова:
боковой амиотрофический склероз, экспрессия генов, генная терапияБиблиографические ссылки
Crivello M, Hogg MC, Jirström E, Halang L, Woods I, Rayner M, Coughlan KS, Lewandowski SA, Prehn JHM (2019) Vascular regression precedes motor neuron loss in the FUS (1-359) ALS mouse model. Disease Models & Mechanisms 12(8): dmm040238. https://doi.org/10.1242/dmm.040238 [Pubmed] [PMC]
de Munter J, Babaevskaya D, Wolters EC, Pavlov D, Lysikova E, Kalueff AV, Gorlova A, Oplatchikova M, Pomytkin IA, Proshin A, Umriukhin A, Lesch KP, Strekalova T (2020) Molecular and behavioural abnormalities in the FUS-tg mice mimic frontotemporal lobar degeneration: Effects of old and new anti-inflammatory therapies. Journal of Cellular and Molecular Medicine 24(17): 10251–10257. https://doi.org/10.1111/jcmm.15628 [Pubmed] [PMC]
Funikov SY, Rezvykh AP, Mazin PV, Morozov AV, Maltsev AV, Chicheva MM, Vikhareva EA, Evgen'ev MB, Ustyugov AA (2018) FUS(1-359) transgenic mice as a model of ALS: pathophysiological and molecular aspects of the proteinopathy. Neurogenetics 19(3): 189–204. https://doi.org/10.1007/s10048-018-0553-9 [PubMed]
Grandchamp N (2020) Pharmacodynamic evaluation: gene therapy. In: Hock F, Gralinski M (Eds) Drug Discovery and Evaluation: Methods in Clinical Pharmacology. Springer, Cham, 361–384 pp. https://doi.org/10.1007/978-3-319-68864-0_51
Korokin MV, Gudyrev OS, Pokrovskaya TG, Danilenko LM, Zhernakova NI, Avtina TV, Parshina AV, Pribylov SA, Lebedev PR, Kochkarov AA, Kuzubova EV, Radchenko AI, Koklin IS, Taran EI (2023) Features of bone remodeling and osteoreparation processes in modeling femoral fracture in genetically modified mice with impaired enzymatic regulation of steroid hormone metabolism. Research Results in Pharmacology 9(4): 113–123. https://doi.org/10.18413/rrpharmacology.9.10062
Polikarpova AV, Egorova TV, Bardina MV (2022) Genetically modified animal models of hereditary diseases for testing of gene-directed therapy. Research Results in Pharmacology 8(2): 11–26. https://doi.org/10.3897/rrpharmacology.8.82618
Probert F, Gorlova A, Deikin A, Bettendorff L, Veniaminova E, Nedorubov A, Chaprov KD, Ivanova TA, Anthony DC, Strekalova T (2022) In FUS[1-359]-tg mice O,S-dibenzoyl thiamine reduces muscle atrophy, decreases glycogen synthase kinase 3 beta, and normalizes the metabolome. Biomedicine & Pharmacotherapy 156: 113986. https://doi.org/10.1016/j.biopha.2022.113986 [Pubmed]
Rezvykh A, Shteinberg D, Bronovitsky E, Ustyugov A, Funikov S (2024) Animal models of FUS-proteinopathy: a systematic review. Biochemistry (Moscow) 89(1): 34–56. https://doi.org/10.1134/S0006297924140037 [Pubmed]
Shelkovnikova TA, Peters OM, Deykin AV, Connor-Robson N, Robinson H, Ustyugov AA, Bachurin SO, Ermolkevich TG, Goldman IL, Sadchikova ER, Kovrazhkina EA, Skvortsova VI, Ling SC, Da Cruz S, Parone PA, Buchman VL, Ninkina NN (2013) Fused in sarcoma (FUS) protein lacking nuclear localization signal (NLS) and major RNA binding motifs triggers proteinopathy and severe motor phenotype in transgenic mice. The Journal of Biological Chemistry 288(35): 25266–25274. https://doi.org/10.1074/jbc.m113.492017 [Pubmed] [PMC]
Yazdani A, Alirezaie Z, Motamedi MJ, Amani J (2018) Gene therapy: a new approach in modern medicine. International Journal of Medical Research 5(3): 105–107. https://doi.org/10.29252/IJMR-050304
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2024 Zhunusov NS

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

