Клинико-гистологическая оценка эффективности комбинированного применения пульс-терапии и молекулярного водорода при лечении экспериментального ревматоидного артрита у крыс
DOI:
https://doi.org/10.18413/rrpharmacology.9.10024Аннотация
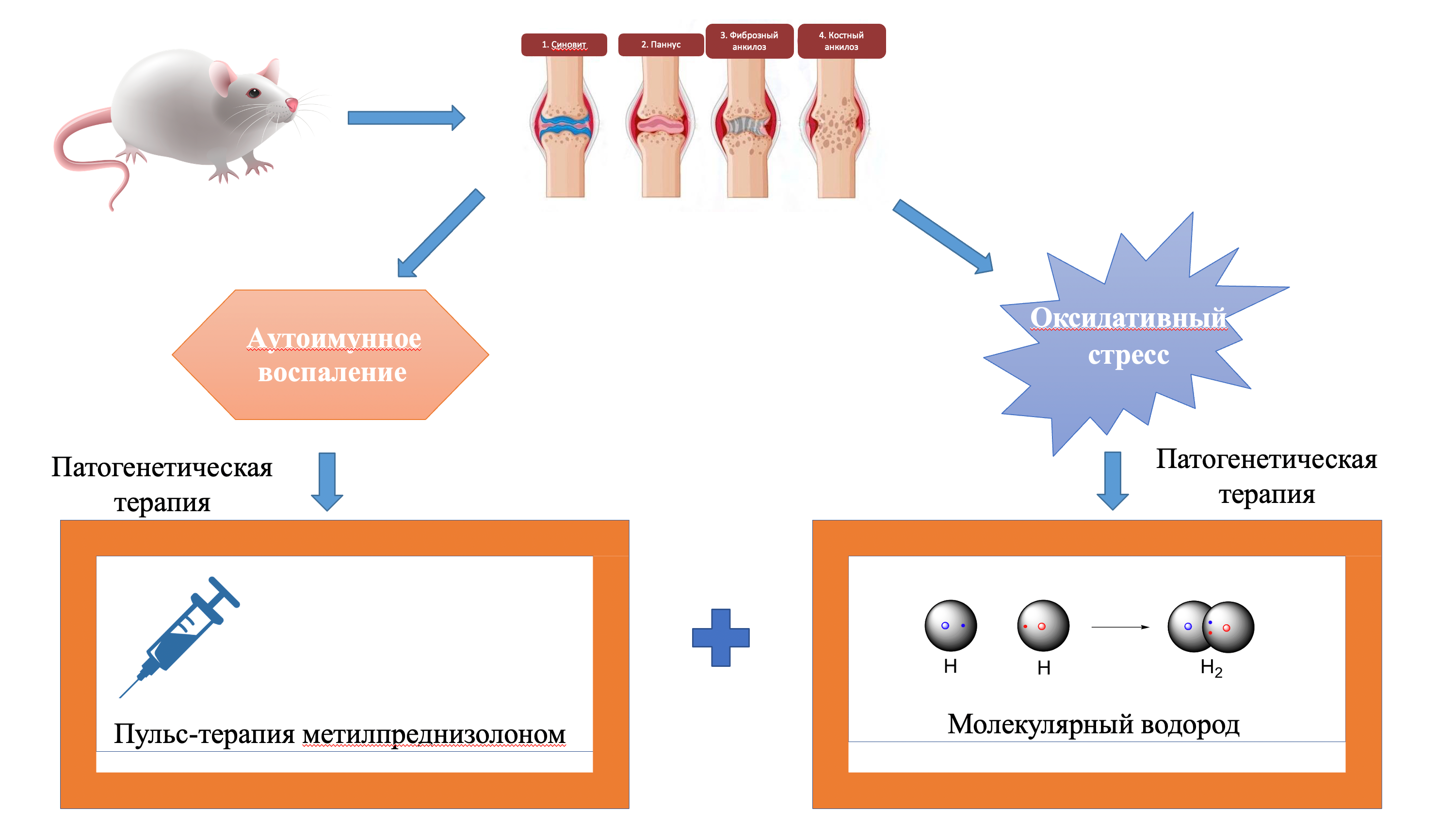
Введение. Терапия глюкокортикостероидами является основным методом лечения ревматоидного артрита, однако длительное лечение низкими и средними дозами связано с развитием побочных эффектов. Как сообщалось, окислительный стресс имеет решающее значение в патогенезе ревматоидного артрита. Таким образом, фармакотерапия, сочетающая применение пульс-терапии метилпреднизолоном и водного раствора молекулярного водорода, представляется разумным вариантом лечения в этих случаях.
Материалы и методы. Изучение эффективности комбинированной фармакотерапии ревматоидного артрита проводили на половозрелых крысах-самцах. Ревматоидный артрит моделировали путем введения в правый коленный сустав бычьего коллагена II типа. Животные 1-й – контрольной группы получали плацебо; животные 2-й группы получали внутрижелудочно воду, обогащенную молекулярным водородом; животные 3-й группы получали раствор метилпреднизолона внутривенно путем катетеризации хвостовой вены, а животные 4-й группы получали воду, обогащенную молекулярным водородом внутрижелудочно, и раствор метилпреднизолона внутривенно. После вывода животных из эксперимента гистологически анализировали микросрезы тканей суставов и иммуногистохимически выявляли биомаркеры воспаления суставов.
Результаты и обсуждение. Морфологический анализ микросрезов животных 4-й группы свидетельствовал об эффективности комбинированной терапии, основанной на количественной оценке экспрессии биомаркеров воспаления. Динамическая поляризация макрофагов М1/М2 у животных этой группы проявлялась качественно.
Заключение. Расширен поиск новых терапевтических возможностей при ревматоидном артрите за счет основных антиоксидантных веществ, позволяющих сократить сроки лечения, обеспечивая при этом положительную динамику течения заболевания.
Графическая аннотация
Ключевые слова:
иммуногистохимический анализ, тучные клетки, молекулярный водород, пульс-терапия, ревматоидный артрит, CD68, CD163, TGF-β1Библиографические ссылки
Abdel Jaleel GA, Azab SS, El-Bakly WM, Hassan A (2021) Methyl palmitate attenuates adjuvant induced arthritis in rats by decrease of CD68 synovial macrophages. Biomedicine & Pharmacotherapy 137: 111347. https://doi.org/10.1016/j.biopha.2021.111347 [PubMed]
Almutairi K, Nossent J, Preen D, Keen H, Inderjeeth C (2021) The global prevalence of rheumatoid arthritis: a meta-analysis based on a systematic review. Rheumatology International 41(5): 863-877. https://doi.org/10.1007/s00296-020-04731-0 [PubMed]
Alwazeer D, Liu FF, Wu XY, LeBaron TW (2021) Combating oxidative stress and inflammation in COVID-19 by molecular hydrogen therapy: Mechanisms and perspectives. Oxidative Medicine and Cellular Longevity 2021: 5513868. https://doi.org/10.1155/2021/5513868 [PubMed] [PMC]
Atiakshin DA, Shishkina VV, Gerasimova OA, Meshkova VY, Samodurova NY, Samoilenko TV, Buchwalow IB, Samoilova VE, Tiemann M (2021) Combined histochemical approach in assessing tryptase expression in the mast cell population. Acta Histochemica 123(4): 151711. https://doi.org/10.1016/j.acthis.2021.151711 [PubMed]
Buch MH, Eyre S, McGonagle D (2021) Persistent inflammatory and non-inflammatory mechanisms in refractory rheumatoid arthritis. Nature Reviews. Rheumatology 17(1): 17-33. https://doi.org/10.1038/s41584-020-00541-7[PubMed]
Charles-Schoeman C, Buch MH, Dougados M, Bhatt DL, Giles JT, Ytterberg SR, Koch GG, Vranic I, Wu J, Wang C, Kwok K, Menon S, Rivas JL, Yndestad A, Connell CA, Szekanecz Z (2023) Risk of major adverse cardiovascular events with tofacitinib versus tumour necrosis factor inhibitors in patients with rheumatoid arthritis with or without a history of atherosclerotic cardiovascular disease: a post hoc analysis from ORAL Surveillance. Annals of the Rheumatic Diseases 82(1): 119-129. https://doi.org/10.1136/ard-2022-222259 [PubMed] [PMC]
Ciurtin C, Jones A, Brown G, Sin FE, Raine C, Manson J, Giles I (2019) Real benefits of ultrasound evaluation of hand and foot synovitis for better characterisation of the disease activity in rheumatoid arthritis. European Radiology 29(11): 6345-6354. https://doi.org/10.1007/s00330-019-06187-8 [PubMed] [PMC]
Cutolo M, Campitiello R, Gotelli E, Soldano S (2022) The role of M1/M2 macrophage polarization in rheumatoid arthritis synovitis. Frontiers in Immunology 13: 867260. https://doi.org/10.3389/fimmu.2022.867260 [PubMed] [PMC]
Genovese MC, Fleischmann R, Combe B, Hall S, Rubbert-Roth A, Zhang Y, Zhou Y, Mohamed MF, Meerwein S, Pangan AL (2018) Safety and efficacy of upadacitinib in patients with active rheumatoid arthritis refractory to biologic disease-modifying anti-rheumatic drugs (SELECT-BEYOND): a double-blind, randomised controlled phase 3 trial. Lancet 391(10139): 2513-2524. https://doi.org/10.1016/S0140-6736(18)31116-4 [PubMed]
Giachi A, Cugno M, Gualtierotti R (2022) Disease-modifying anti-rheumatic drugs improve the cardiovascular profile in patients with rheumatoid arthritis. Frontiers in Cardiovascular Medicine 9: 1012661. https://doi.org/10.3389/fcvm.2022.1012661 [PubMed] [PMC]
Guo S, Jin Y, Zhou J, Zhu Q, Jiang T, Bian Y, Zhang R, Chang C, Xu L, Shen J, Zheng X, Shen Y, Qin Y, Chen J, Tang X, Cheng P, Ding Q, Zhang Y, Liu J, Cheng Q, Guo M, Liu Z, Qiu W, Qian Y, Sun Y, Shen Y, Nie H, Schrodi SJ, He D (2021) MicroRNA variants and HLA-miRNA interactions are novel rheumatoid arthritis susceptibility factors. Frontiers in Genetics 12: 747274. https://doi.org/10.3389/fgene.2021.747274 [PubMed] [PMC]
Hasan D, Chalouhi N, Jabbour P, Hashimoto T (2012) Macrophage imbalance (M1 vs. M2) and upregulation of mast cells in wall of ruptured human cerebral aneurysms: preliminary results. Journal of Neuroinflammation 9: 222. https://doi.org/10.1186/1742-2094-9-222 [PubMed] [PMC]
Hua C, Buttgereit F, Combe B (2020) Glucocorticoids in rheumatoid arthritis: current status and future studies. RMD Open 6(1): e000536. https://doi.org/10.1136/rmdopen-2017-000536 [PubMed] [PMC]
Kalden JR, Schulze-Koops H (2017) Immunogenicity and loss of response to TNF inhibitors: implications for rheumatoid arthritis treatment. Nature Reviews. Rheumatology 13(12): 707-718. https://doi.org/10.1038/nrrheum.2017.187 [PubMed]
Kearsley-Fleet L, Davies R, De Cock D, Watson KD, Lunt M, Buch MH, Isaacs JD, Hyrich KL; BSRBR-RA Contributors Group (2018) Biologic refractory disease in rheumatoid arthritis: results from the British Society for Rheumatology Biologics Register for Rheumatoid Arthritis. Annals of the Rheumatic Diseases 77(10): 1405-1412. https://doi.org/10.1136/annrheumdis-2018-213378 [PubMed] [PMC]
Nagy G, Roodenrijs NMT, Welsing PMJ, Kedves M, Hamar A, van der Goes MC, Kent A, Bakkers M, Pchelnikova P, Blaas E, Senolt L, Szekanecz Z, Choy EH, Dougados M, Jacobs JW, Geenen R, Bijlsma JW, Zink A, Aletaha D, Schoneveld L, van Riel P, Dumas S, Prior Y, Nikiphorou E, Ferraccioli G, Schett G, Hyrich KL, Mueller-Ladner U, Buch MH, McInnes IB, van der Heijde D, van Laar JM (2022) EULAR points to consider for the management of difficult-to-treat rheumatoid arthritis. Annals of the Rheumatic Diseases 81(1): 20-33. https://doi.org/10.1136/annrheumdis-2021-220973 [PubMed] [PMC]
Orlovskaya IA, Tsyrendorzhiev DD, Shchelkunov SN (2015) Rheumatoid arthritis: laboratory models of the disease. Medical Immunology 17(3): 203-210. https://doi.org/10.15789/1563-0625-2015-3-203-210 [in Russian]
Rivellese F, Surace AEA, Goldmann K, Sciacca E, Çubuk C, Giorli G, John CR, Nerviani A, Fossati-Jimack L, Thorborn G, Ahmed M, Prediletto E, Church SE, Hudson BM, Warren SE, McKeigue PM, Humby F, Bombardieri M, Barnes MR, Lewis MJ, Pitzalis C (2022) R4RA collaborative group. Rituximab versus tocilizumab in rheumatoid arthritis: synovial biopsy-based biomarker analysis of the phase 4 R4RA randomized trial. Nature Medicine 28(6): 1256-1268 https://doi.org/10.1038/s41591-022-01789-0 [PubMed] [PMC]
Roodenrijs NMT, Welsing PMJ, van der Goes MC, Tekstra J, Lafeber FPJG, Jacobs JWG, van Laar JM (2021) Healthcare utilization and economic burden of difficult-to-treat rheumatoid arthritis: a cost-of-illness study. Rheumatology 60(10): 4681-4690. https://doi.org/10.1093/rheumatology/keab078 [PubMed]
Samoylenko TV, Shishkina VV, Esaulenko DI, Antakova LN, Gerasimova OA (2021) Features of conducting surgical interventions on Wistar rats under experimental conditions: Textbook for students, residents and postgraduates. Burdenko Voronezh State Medical University, Nauchnaya Kniga, Voronezh, 78 pp. [in Russian]
Smolen JS, Landewé RBM, Bijlsma JWJ, Burmester GR, Dougados M, Kerschbaumer A, McInnes IB, Sepriano A, van Vollenhoven RF, de Wit M, Aletaha D, Aringer M, Askling J, Balsa A, Boers M, den Broeder AA, Buch MH, Buttgereit F, Caporali R, Cardiel MH, De Cock D, Codreanu C, Cutolo M, Edwards CJ, van Eijk-Hustings Y, Emery P, Finckh A, Gossec L, Gottenberg JE, Hetland ML, Huizinga TWJ, Koloumas M, Li Z, Mariette X, Müller-Ladner U, Mysler EF, da Silva JAP, Poór G, Pope JE, Rubbert-Roth A, Ruyssen-Witrand A, Saag KG, Strangfeld A, Takeuchi T, Voshaar M, Westhovens R, van der Heijde D (2020) EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease-modifying antirheumatic drugs: 2019 update. Annals of the Rheumatic Diseases 79: 685–99. https://doi.org/10.1136/ard-2022-223356 [PubMed]
Takanashi S, Kaneko Y, Takeuchi T (2021) Characteristics of patients with difficult-to-treat rheumatoid arthritis in clinical practice. Rheumatology 60(11): 5247-5256. https://doi.org/10.1093/rheumatology/keab209 [PubMed]
Zhao J, Guo S, Schrodi SJ, D H (2021) Molecular and cellular heterogeneity in rheumatoid arthritis: Mechanisms and clinical implications. Frontiers in Immunology 12: 790122. https://doi.org/10.3389/fimmu.2021.790122 [PubMed] [PMC]
 Русский
Русский
 English
English

