Влияние острого плавательного стресса, кортикостерона, дексаметазона и флудрокортизона на тревожноподобное поведение мышей
DOI:
https://doi.org/10.18413/rrpharmacology.11.725Аннотация
Введение. Острый плавательный стресс (ОПС) оказывает двухфазное влияние на тревожноподобное поведение мышей, усиливая его через 1 ч и ослабляя через 24 ч после воздействия стрессового фактора. Данные эффекты могут быть обусловлены активацией минерал- и глюкокортикоидных рецепторов кортикостероидам как во время немедленного ответа на острый стресс, так и в фазу адаптивных изменений после его прекращения.
Цель исследования. Сравнительное изучение эффектов ОПС, кортикостерона, дексаметазона и флудрокортизона на тревожноподобное поведение мышей через 1 ч и 24 ч после воздействия стрессового фактора или введения изучаемых веществ.
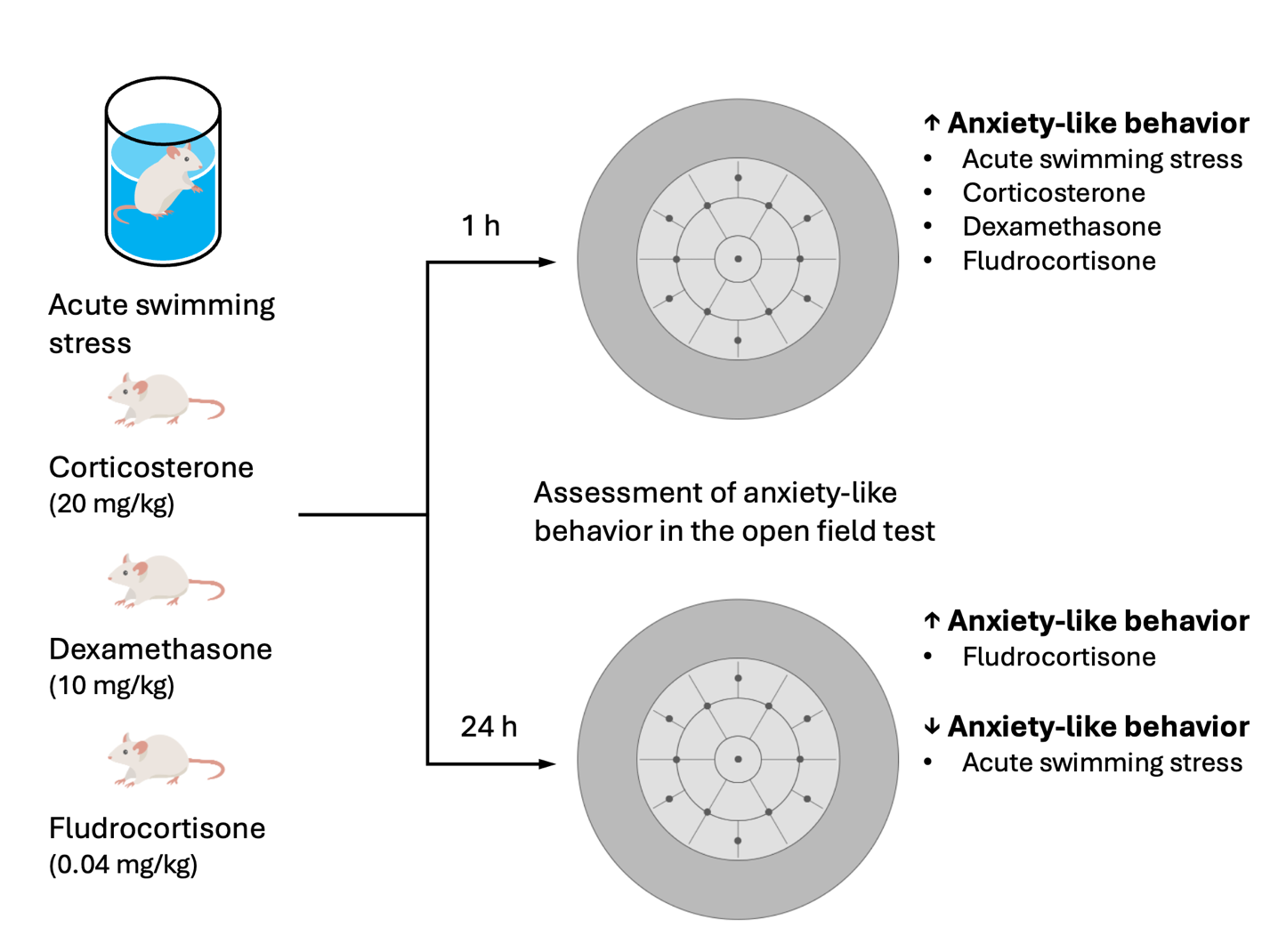
Материалы и методы. Для моделирования ОПС у самцов ICR мышей использовали тест вынужденного плавания, тревожноподобное поведение мышей оценивали в тесте открытое поле через 1 ч и 24 ч после ОПС или системного введения кортикостерона (20 мг/кг), дексаметазона (10 мг/кг) и флудрокортизона (0,04 мг/кг).
Результаты. ОПС через 1 ч после воздействия уменьшал центральную активность и индекс тревожности, а через 24 ч - увеличивал индекс тревожности в тесте открытого поля у мышей по сравнению с интактным контролем. Кортикостерон, дексаметазон и флудрокортизон через 1 ч после введения уменьшали центральную активность и индекс тревожности в тесте открытого поля у мышей по сравнению с контролем. В то же время только флудрокортизон через 24 ч после введения уменьшал центральную активность и общую двигательную активность у мышей в тесте открытого поля по сравнению с контролем.
Заключение. ОПС, кортикостерон, дексаметазон и флудрокортизон через 1 ч после воздействия стрессового фактора или введения характеризовались сходным паттерном усиления тревожноподобного поведения мышей. Однако, через 24 ч после экспозиции FST ослаблял, флудрокортизон усиливал, а кортикостерон и дексаметазон не оказывали какого-либо влияния на тревожноподобное поведение мышей.
Графическая аннотация
Ключевые слова:
острый плавательный стресс, тревога, кортикостерон, дексаметазон, флудрокортизон, мышь, открытое полеБиблиографические ссылки
Atrooz F, Alkadhi KA, Salim S (2021) Understanding stress: Insights from rodent models. Current Research in Neurobiology 2: 100013. https://doi.org/10.1016/j.crneur.2021.100013 [PubMed] [PMC]
Avital A, Richter-Levin G, Leschiner S, Spanier I, Veenman L, Weizman A, Gavish M (2001) Acute and repeated swim stress effects on peripheral benzodiazepine receptors in the rat hippocampus, adrenal, and kidney. Neuropsychopharmacology 25(5): 669–678. https://doi.org/10.1016/S0893-133X(01)00286-X [PubMed]
Bertholomey ML, Nagarajan V, Smith DM, Torregrossa MM (2022) Sex- and age-dependent effects of chronic corticosterone exposure on depressive-like, anxiety-like, and fear-related behavior: Role of amygdala glutamate receptors in the rat. Frontiers in Behavioral Neuroscience 16: 950000. https://doi.org/10.3389/fnbeh.2022.950000 [PubMed] [PMC]
Browne CA, Hanke J, Rose C, Walsh I, Foley T, Clarke G, Schwegler H, Cryan JF, Yilmazer-Hanke D (2014) Effect of acute swim stress on plasma corticosterone and brain monoamine levels in bidirectionally selected DxH recombinant inbred mouse strains differing in fear recall and extinction. Stress 17(6): 471–483. https://doi.org/10.3109/10253890.2014.954104 [PubMed] [PMC]
Can A, Dao DT, Arad M, Terrillion CE, Piantadosi SC, Gould TD (2012) The mouse forced swim test. Journal of Visualized Experiments 59: e3638. https://doi.org/10.3791/3638[PubMed] [PMC]
Christianson JP, Drugan RC, Flyer JG, Watkins LR, Maier SF (2013) Anxiogenic effects of brief swim stress are sensitive to stress history. Progress in Neuro-Psychopharmacology & Biological Psychiatry 44: 17–22. https://doi.org/10.1016/j.pnpbp.2013.01.011 [PubMed] [PMC]
Commons KG, Cholanians AB, Babb JA, Ehlinger DG (2017) The rodent forced swim test measures stress-coping strategy, not depression-like behavior. ACS Chemical Neuroscience 8(5): 955–960. https://doi.org/10.1021/acschemneuro.7b00042 [PubMed] [PMC]
Dieterich A, Srivastava P, Sharif A, Stech K, Floeder J, Yohn SE, Samuels BA (2019) Chronic corticosterone administration induces negative valence and impairs positive valence behaviors in mice. Translational Psychiatry 9(1): 337. https://doi.org/10.1038/s41398-019-0674-4 [PubMed] [PMC]
Dinel AL, Guinobert I, Lucas C, Blondeau C, Bardot V, Ripoche I, Berthomier L, Pallet V, Layé S, Joffre C (2019) Reduction of acute mild stress corticosterone response and changes in stress-responsive gene expression in male Balb/c mice after repeated administration of a Rhodiola rosea L. root extract. Food Science & Nutrition 7(11): 3827–3841. https://doi.org/10.1002/fsn3.1249 [PubMed] [PMC]
Fediuc S, Campbell JE, Riddell MC. (2006) Effect of voluntary wheel running on circadian corticosterone release and on HPA axis responsiveness to restraint stress in Sprague-Dawley rats. Journal of Applied Physiology 100(6): 1867–1875. https://doi.org/10.1152/japplphysiol.01416.2005 [PubMed]
Hartmann J, Bajaj T, Klengel C, Chatzinakos C, Ebert T, Dedic N, McCullough KM, Lardenoije R, Joëls M, Meijer OC, McCann KE, Dudek SM, Sarabdjitsingh RA, Daskalakis NP, Klengel T, Gassen NC, Schmidt MV, Ressler KJ (2021) Mineralocorticoid receptors dampen glucocorticoid receptor sensitivity to stress via regulation of FKBP5. Cell Reports 35(9): 109185. https://doi.org/10.1016/j.celrep.2021.109185 [PubMed] [PMC]
Hoeijmakers L, Harbich D, Schmid B, Lucassen PJ, Wagner KV, Schmidt MV, Hartmann J (2014) Depletion of FKBP51 in female mice shapes HPA axis activity. PLoS One 9(4): e95796. https://doi.org/10.1371/journal.pone.0095796 [PubMed] [PMC]
Kloet de ER, Molendijk ML (2016) Coping with the forced swim stressor: Towards understanding an adaptive mechanism. Neural Plasticity 2016: 6503162. https://doi.org/10.1155/2016/6503162 [PubMed] [PMC]
Kloet de ER (2022) Brain mineralocorticoid and glucocorticoid receptor balance in neuroendocrine regulation and stress-related psychiatric etiopathologies. Current Opinion in Endocrine and Metabolic Research 24: 100352. https://doi.org/10.1016/j.coemr.2022.100352 [PubMed] [PMC]
Kudryashov NV, Naplekova PL, Volkova AV, Kasabov KA, Narkevich VB, Kudrin VS, Kalinina TS, Voronina TA (2022) Effects of acute swimming stress on the behavioral and neurochemical effects of pyrazolo[c]pyridine derivative GIZh-72 and diazepam in BALB/c and C57BL/6 mice. Neuroscience and Behavioral Physiology 52: 135–149. https://doi.org/1007/s11055-022-01215-5
Laviolle B, Nesseler N, Massart C, Bellissant E (2014) Fludrocortisone and hydrocortisone, alone or in combination, on in vivo hemodynamics and in vitro vascular reactivity in normal and endotoxemic rats: a randomized factorial design study. Journal of Cardiovascular Pharmacology 63(6): 488–496. https://doi.org/10.1097/FJC.0000000000000072 [PubMed]
Molendijk ML, Kloet de ER (2022) Forced swim stressor: Trends in usage and mechanistic consideration. The European Journal of Neuroscience 55(9-10): 2813–2831. https://doi.org/10.1111/ejn.15139 [PubMed] [PMC]
Myers B, Greenwood-Van Meerveld B (2010) Divergent effects of amygdala glucocorticoid and mineralocorticoid receptors in the regulation of visceral and somatic pain. American Journal of Physiology. Gastrointestinal and Liver Physiology 298(2): G295–G303. https://doi.org/10.1152/ajpgi.00298.2009 [PubMed]
Oakley RH, Riddick NV, Moy SS, Cidlowski JA (2023) Imbalanced glucocorticoid and mineralocorticoid stress hormone receptor function has sex-dependent and independent regulatory effects in the mouse hippocampus. Neurobiology Stress 28: 100589. https://doi.org/10.1016/j.ynstr.2023.100589 [PubMed] [PMC]
Pesarico AP, Birmann PT, Pinto R, Padilha NB, Lenardão EJ, Savegnago L (2020) Short- and long-term repeated forced swim stress induce depressive-like phenotype in mice: Effectiveness of 3-[(4-chlorophenyl)selanyl]-1-methyl-1h-indole. Frontiers in Behavioral Neuroscience 14: 140. https://doi.org/10.3389/fnbeh.2020.00140 [PubMed] [PMC]
Porsolt RD, Le Pichon M, Jalfre M (1977) Depression: A new animal model sensitive to antidepressant treatments. Nature 266(5604): 730–732. https://doi.org/10.1038/266730a0 [PubMed]
Ruiz-Sánchez E, López-Ramírez AM, Ruiz-Chow Á, Calvillo M, Reséndiz-Albor AA, Anguiano B, Rojas P (2021) Variability in behavioral phenotypes after forced swimming-induced stress in rats is associated with expression of the glucocorticoid receptor, nurr1, and IL-1β in the hippocampus. International Journal of Molecular Sciences 22(23): 12700. https://doi.org/10.3390/ijms222312700 [PubMed] [PMC]
Vafaei AA, Rashidy-Pour A, Taherian AA. (2008) Peripheral injection of dexamethasone modulates anxiety related behaviors in mice: an interaction with opioidergic neurons. Pakistan Journal of Pharmaceutical Sciences 21(3): 285–289. [PubMed]
Wei Q, Lu XY, Liu L, Schafer G, Shieh KR, Burke S, Robinson TE, Watson SJ, Seasholtz AF, Akil H (2004) Glucocorticoid receptor overexpression in forebrain: a mouse model of increased emotional lability. Proceedings of the National Academy of Sciences of the United States of America 101(32): 11851–11856. https://doi.org/10.1073/pnas.0402208101[PubMed] [PMC]
Zhao Y, Ma R, Shen J, Su H, Xing D, Du L (2008) A mouse model of depression induced by repeated corticosterone injections. European Journal of Pharmacology 581(1-2): 113–120. https://doi.org/10.1016/j.ejphar.2007.12.005 [PubMed]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2025 Kudryashov NV, Gorbunov AA, Mironov SE, Tikhonov DA, Nedorubov AA, Arshinova OYu, Simukhina MA, Busol VN, Fisenko VP

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

