Особенности процессов костного ремоделирования и остеорепарации при моделировании перелома бедра у генетически модифицированных мышей с нарушенной ферментативной регуляцией метаболизма стероидных гормонов
DOI:
https://doi.org/10.18413/rrpharmacology.9.10062Аннотация
Введение: Целью настоящего исследования стала оценка процессов костного ремоделирования и остеорепарации при моделировании перелома бедренной кости у мышей у которых отсутствовала экспрессия 11β-HSD2 (11β-HSD2-/-) или у которых отсутствовала экспрессия 11β-HSD2 и аполипопротеина Е (11β-HSD2-/- APOe -/-).
Материалы и методы: Экспериментальное исследование проводилось на 60 самцах мышей массой 24-30 г. В исследовании использовали мышей-самцов, у которых отсутствовала экспрессия 11β-HSD2 (нокаутные мыши с генотипом Hsd2-/-), и мышей-самцов, у которых отсутствовала экспрессия 11β-HSD2 и аполипопротеина Е (двойные нокаутные мыши с генотипом Hsd2-/-/Apoe-/-). В группу контроля включены животные дикого типа C57bl/6. Моделирование перелома проксимального метафиза бедренной кости производили у животных в возрасте 6 месяцев по закрытой методике. Оценку сращения переломов и процессов костного ремоделирования и остеорепарации проводили через 6 недель после моделирования перелома.
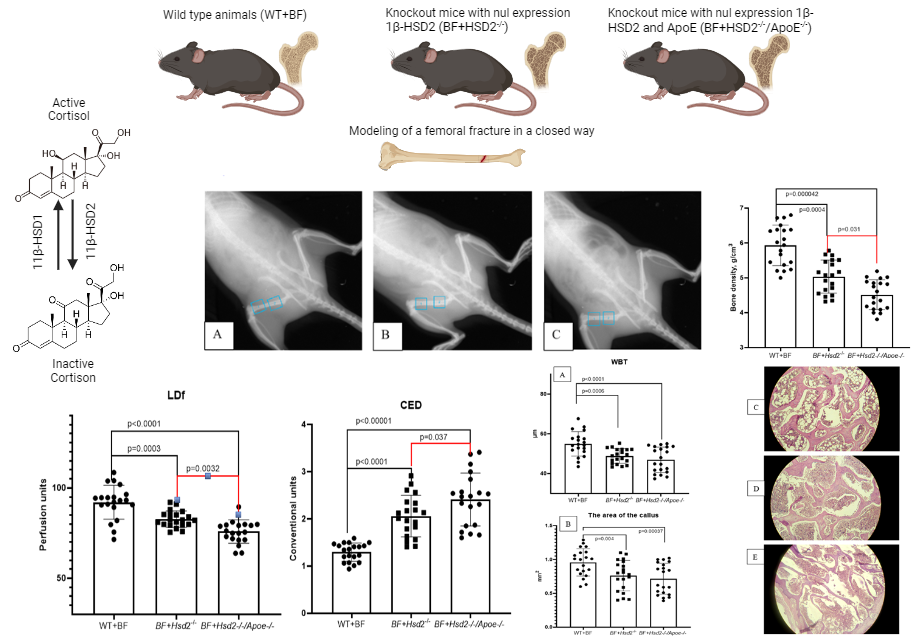
Результаты: Показано, что нарушение регуляции обмена стероидных гормонов в группах животных с генотипами Hsd2-/-и Hsd2-/-/ ApoE-/- приводит к увеличению количества несросшихся переломов в 3 и 3,5 раза соответственно в сравнении с животными дикого типа. Установлено, что уровень микроциркуляции проксимального метафиза левой бедренной кости в области сформировавшейся костной мозоли в группе животных с генотипом 11β-HSD2-/- достоверно снизился с 92,075±4,33 перфузионных единиц (ПЭ) в группе животных дикого типа до 82,67±3,54 ПЭ (р=0,0002) в группе группе животных с генотипом HSD2-/- и до 75,85±5,64 (р<0,0001) в группе мышей с генотипом Hsd2-/-/Apoe-/-. При расчете коэффициента эндотелиальной дисфункции обнаружено увеличение коэффициента эндотелиальной дисфункции с 1,297±0,19 у интактных животных до 2,115±0,45 (р<0,00001) в группе мышей с генотипом Hsd2-/- и до 2,41±0,04 (р<0,00001) в группе мышей с генотипом Hsd2-/-/Apoe-/-. У животных с нарушением обмена кортизола отмечалось замедление формирования костной ткани в области перелома костные трабекулы имели меньшую ширину в просвете между костными отломками наблюдались большие количества фиброзной и соединительной ткани, отмечено увеличение межтрабекулярных пространств
Заключение: Подтвержденная в данном исследовании тесная связь между метаболизмом 11β-HSD2 и NO может рассматриваться как перспективная фармакотерапевтическая мишень. Очевидно, что подходы к изменению активности 11β-HSD имеют значительный терапевтический потенциал в лечении остеопороза, нарушений костного ремоделирования и остеорепарации при переломах на фоне сформировавшихся остеопоротических изменений при нарушении обмена стероидных гормонов.
Графическая аннотация
Ключевые слова:
остеопороз, плотность костной ткани, метаболизм стероидных гормонов, трансгенные животные, 11β-HSD2, ApoE, Hsd2-/-, Hsd2-/-/Apoe-/-Библиографические ссылки
Ballane G, Cauley JA, Luckey MM, Fuleihan Gel-H (2014) Secular trends in hip fractures worldwide: Opposing trends East versus West. Journal of Bone and Mineral Research 29(8): 1745–1755. https://doi.org/10.1002/jbmr.2218 [PubMed]
Camacho PM, Petak SM, Binkley N, Diab DL, Eldeiry LS, Farooki A, Harris ST, Hurley DL, Kelly J, Lewiecki EM, Pessah-Pollack R, McClung M, Wimalawansa SJ, Watts NB (2020) American Association of Clinical Endocrinologists / American College of Endocrinology clinical practice guidelines for the diagnosis and treatment of postmenopausal osteoporosis – 2020 update executive summary. Endocrine Practice 26(5): 564–570. https://doi.org/10.4158/GL-2020-0524 [PubMed]
de Souza MP (2010) Osteoporosis diagnosis and treatment. Revista Brasileira de Ortopedia 45(3): 220–229. [PubMed] [PMC]
Deuchar GA, McLean D, Hadoke PWF, Brownstein DG, Webb DJ, Mullins JJ, Chapman K, Seckl JR, Kotelevtsev YV (2011) 11β-hydroxysteroid dehydrogenase type 2 deficiency accelerates atherogenesis and causes proinflammatory changes in the endothelium in apoe-/- mice. Endocrinology 152(1): 236–246. https://doi.org/10.1210/en.2010-0925 [PubMed] [PMC]
Dube S, Norby BJ, Pattan V, Carter RE, Basu A, Basu R (2015) 11β-hydroxysteroid dehydrogenase types 1 and 2 activity in subcutaneous adipose tissue in humans: Implications in obesity and diabetes. The Journal of Clinical Endocrinology and Metabolism 100(1): E70–E76. https://doi.org/10.1210/jc.2014-3017 [PubMed] [PMC]
Engström A, Michaëlsson K, Vahter M, Julin B, Wolk A, Åkesson A (2019) Associations between dietary cadmium exposure and bone mineral density and risk of osteoporosis and fractures among women. Bone 50(6): 1372–1378. https://doi.org/10.1016/j.bone.2012.03.018 [PubMed]
Korokin MV, Gudyrev OS, Lebedev PR, Kuzubova EV, Radchenko AI, Koklin IS, Taran EI, Kochkarov AA (2022a) Characteristics of the state of bone tissue in genetically modified mice with impaired enzymatic regulation of steroid hormone metabolism. Research Results in Pharmacology 8(4): 157–166. https://doi.org/10.3897/rrpharmacology.8.98779
Korokin MV, Soldatov VO, Gudyrev OS (2022b) The role of cortisol metabolism in the realization of pathogenetic links in the development of osteoporosis – the rationale for the search for new pharmacotherapeutic targets (review). Research Results in Biomedicine. 8(4): 457–473. [in Russian]
Lou S, Lv H, Yin P, Li Z, Tang P, Wang Y (2019) Combination therapy with parathyroid hormone analogs and antiresorptive agents for osteoporosis: A systematic review and meta-analysis of randomized controlled trials. Osteoporosis International 30(1): 59–70. https://doi.org/10.1007/s00198-018-4790-4 [PubMed]
Nogués X, Carbonell MC, Canals L, Lizán L, Palacios S (2022) Current situation of shared decision making in osteoporosis: A comprehensive literature review of patient decision aids and decision drivers. Health Science Reports 5(6): e849. https://doi.org/10.1002/hsr2.849 [PubMed] [PMC]
Rozenberg S, Bruyère O, Bergmann P, Cavalier E, Gielen E, Goemaere S, Kaufman JM, Lapauw B, Laurent MR, De Schepper J, Body JJ (2020) How to manage osteoporosis before the age of 50. Maturitas 138: 14–25. https://doi.org/10.1016/j.maturitas.2020.05.004 [PubMed]
Tabatabaei-Malazy O, Salari P, Khashayar P, Larijani B (2017) New horizons in treatment of osteoporosis. Daru 25(1): 2. https://doi.org/10.1186/s40199-017-0167-z [PubMed] [PMC]
Vidal M, Thibodaux RJ, Neira LFV, Messina OD (2019) Osteoporosis: A clinical and pharmacological update. Clinical Rheumatology 38(2): 385–395. https://doi.org/10.1007/s10067-018-4370-1 [PubMed]
Weaver CM, Gordon CM, Janz KF, Kalkwarf HJ, Lappe JM, Lewis R, O'Karma M, Wallace TC, Zemel BS (2016) The national osteoporosis foundation’s position statement on peak bone mass development and lifestyle factors: A systematic review and implementation recommendations. Osteoporosis International (2016) 27: 1281–1386. https://doi.org/10.1007/s00198-015-3440-3 [PubMed] [PMC]
Weinstein RS, Wan C, Liu Q, Wang Y, Almeida M, O'Brien CA, Thostenson J, Roberson PK, Boskey AL, Clemens TL, Manolagas SC (2010) Endogenous glucocorticoids decrease skeletal angiogenesis, vascularity, hydration, and strength in aged mice. Aging Cell 9(2): 147–161. https://doi.org/10.1111/j.1474-9726.2009.00545.x [PubMed] [PMC]
Zhang H, Zhou F, Pan Z, Bu X, Wang Y, Chen F (2017) 11β-hydroxysteroid dehydrogenases-2 decreases the apoptosis of MC3T3/MLO-Y4 cells induced by glucocorticoids. Biochemical and Biophysical Research Communications 490(4): 1399–1406. https://doi.org/10.1016/j.bbrc.2017.07.046 [PubMed]
Zhao B, Xing G, Wang A (2019) The BMP signaling pathway enhances the osteoblastic differentiation of bone marrow mesenchymal stem cells in rats with osteoporosis. Journal of Orthopaedic Surgery and Research 14(1): 462. https://doi.org/10.1186/s13018-019-1512-3 [PubMed] [PMC]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2023 Mikhail V. Korokin, Oleg S. Gudyrev, Petr R. Lebedev, Alim A. Kochkarov, Tatiana G. Pokrovskaya, Lyudmila M. Danilenko, Nina I. Zhernakova, Tatyana V. Avtina, Sergey A. Pribylov, Alina V. Parshina, Elena V. Kuzubova, Alexandra I. Radchenko, Ivan S. Koklin, Eduard I. Taran

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

