Префронтальная кора как мишень для атипичного антипсихотика РУ-31 с антагонистической активностью к 5-HT2A рецепторам в терапии когнитивных нарушений
DOI:
https://doi.org/10.18413/rrpharmacology.11.537Аннотация
Введение: Когнитивные нарушения при шизофрении трудно купируются даже современными нейролептиками. В связи с этим 5-HT2A-рецептор рассматривается как перспективная терапевтическая мишень благодаря его модулирующему влиянию на дофаминергическую нейротрансмиссию в префронтальной коре (ПФК) и участию в когнитивных процессах. РУ-31 (1-(2-диэтиламиноэтил)-2-(4-метоксифенил)-имидазо[1,2-a]бензимидазол), селективный антагонист 5-HT2A-рецепторов, может улучшать когнитивные функции без проявления побочных эффектов, характерных для дофаминергических средств.
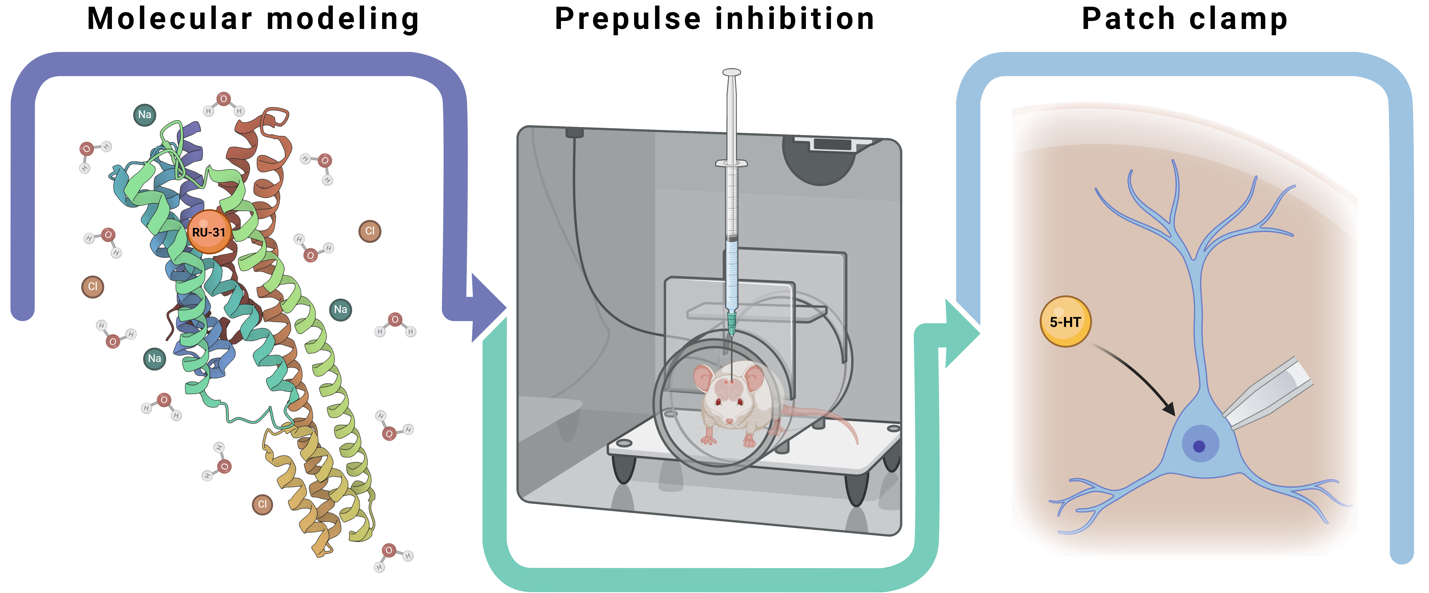
Материалы и Методы: Влияние RU-31 изучали на крысах линии Sprague Dawley с применением молекулярного моделирования, поведенческих тестов in vivo и электрофизиологических методов ex vivo. Методами молекулярной динамики и докинга оценивали параметры взаимодействия РУ-31 с 5-HT2A-рецептором. Для оценки сенсомоторной фильтрации использовали тест преимпульсного торможения (PPI) (n=40) после однократной микроинъекции РУ-31 в ПФК. Влияние РУ-31 на серотонинергическую нейропередачу исследовали методом patch clamp (n=32) на пирамидных нейронах ПФК.
Результаты: Молекулярное моделирование показало высокое сродство РУ-31 к 5-HT2A-рецептору с образованием стабильных комплексов в течение 100 нс моделирования. Соединение РУ-31 (30 мкг) способствовало восстановлению показателей PPI на 34.94% (p<0.05) на модели кетамин-индуцированного когнитивного дефицита, что свидетельствует об улучшении сенсомоторной фильтрации. В электрофизиологических экспериментах РУ-31 (10 мкМ) достоверно снижало амплитуду 5-HT-индуцированных исходящих токов в пирамидных нейронах VI слоя на 59.11% до 20.54 пА (SEM=7.12; SD=20.14; p<0.0211). Это подтверждает выраженную антагонистическую активность соединения в отношении 5-HT2A-рецепторов и указывает на потенциальное усиление нисходящих влияний из ПФК.
Заключение: Результаты данного исследования позволяют рассматривать RU-31 как перспективное средство для коррекции когнитивных нарушений при шизофрении. Показано, что за счет блокирования 5-HT2A-рецепторов вещество устраняет нарушения сенсомоторного гейтинга и нормализует нейрональную активность в префронтальной коре.
Графическая аннотация
Ключевые слова:
антипичные антипсихотики, 5-HT2A рецепторы, бензимидазолы, молекулярный докинг, молекулярная динамика, patch clamp, препульсовое ингибирование, префронтальная кора, шизофрения, когнитивный дефицитБиблиографические ссылки
Bortolozzi A, Masana M, Díaz-Mataix L, Cortés R, Scorza MC, Gingrich JA, Toth M, Artigas F (2010) Dopamine release induced by atypical antipsychotics in prefrontal cortex requires 5-HT(1A) receptors but not 5-HT(2A) receptors. The International Journal of Neuropsychopharmacology 13(10): 1299–1314. https://doi.org/10.1017/S146114571000009X[PubMed] [PMC]
Bubser M, Koch M (1994) Prepulse inhibition of the acoustic startle response of rats is reduced by 6-hydroxydopamine lesions of the medial prefrontal cortex. Psychopharmacology 113(3-4): 487–492. https://doi.org/10.1007/BF02245228 [PubMed]
Celada P, Puig MV, Artigas F (2013) Serotonin modulation of cortical neurons and networks. Frontiers in Integrative Neuroscience 7: 25. https://doi.org/10.3389/fnint.2013.00025 [PubMed] [PMC]
De Deurwaerdère P, Chagraoui A, Di Giovanni G (2021) Serotonin/dopamine interaction: Electrophysiological and neurochemical evidence. Progress in Brain Research 261: 161–264. https://doi.org/10.1016/bs.pbr.2021.02.001 [PubMed]
Frohlich J, Van Horn JD (2014) Reviewing the ketamine model for schizophrenia. Journal of Psychopharmacology (Oxford, England) 28(4): 287–302. https://doi.org/10.1177/0269881113512909
Gebreegziabhere Y, Habatmu K, Mihretu A, Cella M, Alem A (2022) Cognitive impairment in people with schizophrenia: an umbrella review. European Archives of Psychiatry and Clinical Neuroscience 272(7): 1139–1155. https://doi.org/10.1007/s00406-022-01416-6 [PubMed] [PMC]
Habtewold TD, Rodijk LH, Liemburg EJ, Sidorenkov G, Boezen HM, Bruggeman R, Alizadeh B Z (2020) A systematic review and narrative synthesis of data-driven studies in schizophrenia symptoms and cognitive deficits. Translational Psychiatry 10(1): 244. https://doi.org/10.1038/s41398-020-00919-x [PubMed] [PMC]
Hanson KL, Grant SE, Funk LH, Schumann CM, Bauman MD (2022) Impact of maternal immune activation on nonhuman primate prefrontal cortex development: insights for schizophrenia. Biological Psychiatry 92(6): 460–469. https://doi.org/10.1016/j.biopsych.2022.04.004 [PubMed] [PMC]
Howes OD, Bukala BR, Beck K (2024) Schizophrenia: from neurochemistry to circuits, symptoms and treatments. Nature Reviews. Neurology 20(1): 22–35. https://doi.org/10.1038/s41582-023-00904-0 [PubMed]
Ichikawa J, Ishii H, Bonaccorso S, Fowler WL, O’Laughlin IA, Meltzer HY (2001) 5-HT(2A) and D(2) receptor blockade increases cortical DA release via 5-HT(1A) receptor activation: a possible mechanism of atypical antipsychotic-induced cortical dopamine release. Journal of Neurochemistry 76(5): 1521–1531. https://doi.org/10.1046/j.1471-4159.2001.00154.x[PubMed]
Kalitin KY, Pridvorov GV, Spasov AA, Mukha OY (2022) Effect of clozapine and 5-HT2A-antagonist RU-31 on electroencephalography and motor activity of rats in a model of schizophrenia with neonatal destruction of the ventral hippocampus. Kuban Scientific Medical Bulletin 29(5): 108-122. https://doi.org/10.25207/1608-6228-2022-29-5-108-122
Lobo MC, Whitehurst TS, Kaar SJ, Howes OD (2022) New and emerging treatments for schizophrenia: a narrative review of their pharmacology, efficacy and side effect profile relative to established antipsychotics. Neuroscience and Biobehavioral Reviews 132: 324–361. https://doi.org/10.1016/j.neubiorev.2021.11.032 [PubMed]
López-Gil X, Babot Z, Amargós-Bosch M, Suñol C, Artigas F, Adell A (2007) Clozapine and haloperidol differently suppress the MK-801-increased glutamatergic and serotonergic transmission in the medial prefrontal cortex of the rat. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology 32(10): 2087–2097. https://doi.org/10.1038/sj.npp.1301356 [PubMed]
McCutcheon RA, Keefe RS.E, McGuire PK (2023) Cognitive impairment in schizophrenia: aetiology, pathophysiology, and treatment. Molecular Psychiatry 28(5): 1902–1918. https://doi.org/10.1038/s41380-023-01949-9 [PubMed] [PMC]
McLean SL, Harte MK, Neill JC, Young AM (2017) Dopamine dysregulation in the prefrontal cortex relates to cognitive deficits in the sub-chronic PCP-model for schizophrenia: A preliminary investigation. Journal of Psychopharmacology (Oxford, England) 31(6): 660–666. https://doi.org/10.1177/0269881117704988 [PubMed]
Menon, V, D'Esposito M (2022) The role of PFC networks in cognitive control and executive function. Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology 47(1): 90–103. https://doi.org/10.1038/s41386-021-01152-w[PubMed] [PMC]
Mocci G, Jiménez-Sánchez L, Adell A, Cortés R, Artigas F (2014). Expression of 5-HT2A receptors in prefrontal cortex pyramidal neurons projecting to nucleus accumbens. Potential relevance for atypical antipsychotic action. Neuropharmacology 79: 49–58. https://doi.org/10.1016/j.neuropharm.2013.10.021 [PubMed]
Nikolaus S, Chao OY, Henke J, Beu M, Fazari B, Almeida FR, Abdel-Hafiz L, Antke C, Hautzel H, Mamlins E, Müller HW, Huston JP, von Gall C, Giesel FL (2024) 5-HT1A and 5-HT2A receptor effects on recognition memory, motor/exploratory behaviors, emotionality and regional dopamine transporter binding in the rat. Behavioural Brain Research 469: 115051. https://doi.org/10.1016/j.bbr.2024.115051 [PubMed]
Pelevin A, Kurzina N, Zavialov V, Volnova A (2023) A custom solution for acoustic startle response setup with spike2-based data acquisition interface. Methods and Protocols 6(3): 57. https://doi.org/10.3390/mps6030057 [PubMed] [PMC]
Singh S, Khanna D, Kalra S (2020) Role of neurochemicals in schizophrenia. Current Psychopharmacology 9(2): 144-161. https://doi.org/10.2174/2211556009666200401150756
Swerdlow NR, Light GA (2016) Animal models of deficient sensorimotor gating in schizophrenia: are they still relevant?. Current Topics in Behavioral Neurosciences 28: 305–325. https://doi.org/10.1007/7854_2015_5012 [PubMed]
Tian MK, Schmidt EF, Lambe EK (2016) Serotonergic suppression of mouse prefrontal circuits implicated in task attention. eNeuro 3(5): ENEURO.0269-16.2016. https://doi.org/10.1523/ENEURO.0269-16.2016 [PubMed] [PMC]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2025 Kalitin KY, Mukha OY, Voynov VB, Spasov AA

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

