Белки с тетрапептидным мотивом HAEE как потенциальные мишени бета-амилоида
DOI:
https://doi.org/10.18413/rrpharmacology.11.1046Аннотация
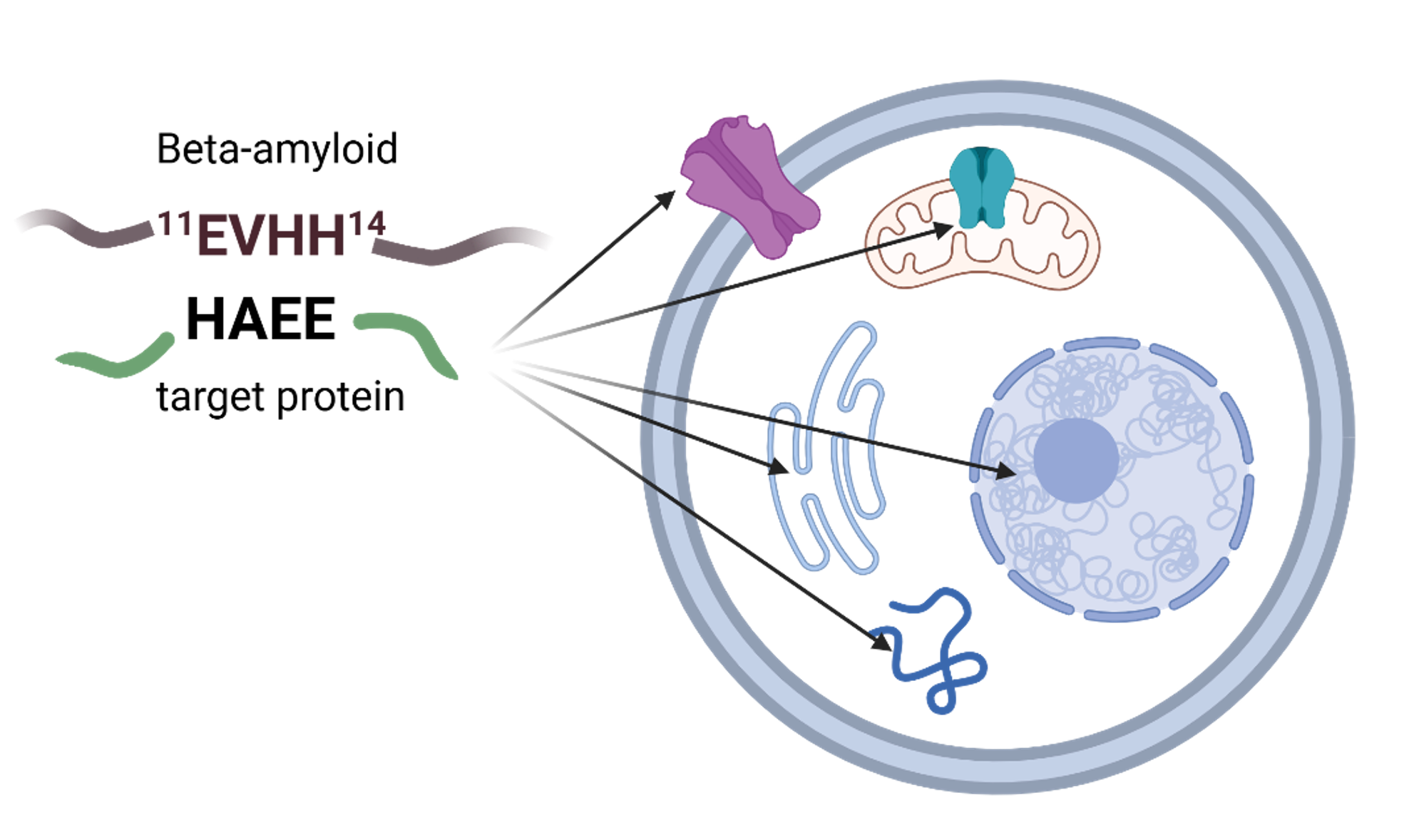
Введение: Бета-амилоид (Aβ) участвует в многочисленных физиологических и патофизиологических процессах и является одним из ключевых игроков в патогенезе болезни Альцгеймера. Aβ взаимодействует с сайтом 35-HAEE-38 α4-субъединицы никотинового ацетилхолинового рецептора α4β2. Синтетический тетрапептид HAEE эффективно ингибирует агрегацию эндогенного Aβ. HAEE специфически связывается с сайтом 11-EVHH-14 Aβ как в отсутствие, так и в присутствии ионов цинка, что приводит к образованию стабильных комплексов. Мы выдвинули гипотезу, что мотив HAEE может представлять собой универсальный сайт связывания для Aβ в протеоме человека.
Материалы и методы: Для проверки этой гипотезы был проведен полномасштабный поиск всех аминокислотных последовательностей, содержащих мотив HAEE, в протеоме человека (Homo sapiens) с использованием сервера PepString (http://pepstring.eimb.ru/). Консервативность идентифицированных сайтов была проанализирована среди челюстноротых позвоночных с помощью программы BLAST. Локализация и структурные особенности белков определялись на основе данных UniProt, PDB и AlphaFold.
Результаты: Нами было идентифицировано 85 белков (включая 200 изоформ), содержащих мотив HAEE. Из них 26 белков являются мембранными, включая рецепторы, ионные каналы и транспортеры (например, CACNA1B, MRS2, SLC15A2), а 59 — внутриклеточными, в основном ядерными транскрипционными факторами (включая 13 цинковых пальцев). Структурный анализ показал, что мотив HAEE часто расположен в функционально значимых доменах, таких как цитоплазматические петли трансмембранных белков или ДНК-связывающие домены.
Заключение: Учитывая, что Aβ действует как внеклеточный лиганд и также способен проникать в различные внутриклеточные компартменты, все идентифицированные белки с мотивом HAEE рассматриваются как потенциальные физиологические и патофизиологические мишени для Aβ. Наиболее перспективными кандидатами являются белки, чьи HAEE-сайты структурно сходны с таковыми в α4β2-nAChR и/или координируют ионы цинка. Эти результаты углубляют наше понимание молекулярных механизмов функции Aβ и открывают новые пути для поиска терапевтических мишеней при БА.
Графическая аннотация
Ключевые слова:
Болезнь Альцгеймера, бета-амилоид, молекулярные мишени, короткие линейные мотивы, биоинформатический анализ, протеом, НАЕЕБиблиографические ссылки
Altschul SF, Gish W, Miller W, Myers EW, Lipman DJ (1990) Basic local alignment search tool. Journal of Molecular Biology 215(3): 403–410. https://doi.org/10.1016/S0022-2836(05)80360-2 [PubMed]
Anwar MU, Sergeeva OA, Abrami L, Mesquita FS, Lukonin I, Amen T, Chuat A, Capolupo L, Liberali P, D’Angelo G, Goot FG van der (2022) ER-Golgi-localized proteins TMED2 and TMED10 control the formation of plasma membrane lipid nanodomains. Developmental Cell 57(19): 2334–2346.e8. https://doi.org/10.1016/j.devcel.2022.09.004 [PubMed]
Barykin EP, Garifulina AI, Tolstova AP, Anashkina AA, Adzhubei AA, Mezentsev YV, Shelukhina IV, Kozin SA, Tsetlin VI, Makarov AA (2020) Tetrapeptide Ac-HAEE-NH2 protects α4β2 nAChR from inhibition by Aβ. International Journal of Molecular Sciences 21: 6272. https://doi.org/10.3390/ijms21176272 [PubMed] [PMC]
Brothers HM, Gosztyla ML, Robinson SR (2018) The physiological roles of amyloid-β peptide hint at new ways to treat Alzheimer’s disease. Frontiers in Aging Neuroscience 10: 118. https://doi.org/10.3389/fnagi.2018.00118 [PubMed] [PMC]
Cadoni MPL, Coradduzza D, Congiargiu A, Sedda S, Zinellu A, Medici S, Nivoli AM, Carru C (2024) Platelet dynamics in neurodegenerative disorders: investigating the role of platelets in neurological pathology. Journal of Clinical Medicine 13(7): 2102. https://doi.org/10.3390/jcm13072102 [PubMed] [PMC]
Chen G-F, Xu T-H, Yan Y, Zhou Y-R, Jiang Y, Melcher K, Xu HE (2017) Amyloid beta: structure, biology and structure-based therapeutic development. Acta Pharmacologica Sinica 38(9): 1205–1235. https://doi.org/10.1038/aps.2017.28 [PubMed] [PMC]
Chertkova RV, Brazhe NA, Bryantseva TV, Nekrasov AN, Dolgikh DA, Yusipovich AI, Sosnovtseva O, Maksimov GV, Rubin AB, Kirpichnikov MP (2017) New insight into the mechanism of mitochondrial cytochrome c function. PLoS ONE 12(5): e0178280.https://doi.org/10.1371/journal.pone.0178280 [PubMed] [PMC]
Cohen SIA, Linse S, Luheshi LM, Hellstrand E, White DA, Rajah L, Otzen DE, Vendruscolo M, Dobson CM, Knowles TPJ (2013) Proliferation of amyloid-β42 aggregates occurs through a secondary nucleation mechanism. Proceedings of the National Academy of Sciences 110(24): 9758–9763. https://doi.org/10.1073/pnas.1218402110 [PubMed] [PMC]
Gao S, Yao X, Yan N (2021) Structure of human Cav2.2 channel blocked by the painkiller ziconotide. Nature 596(7870): 143–147. https://doi.org/10.1038/s41586-021-03699-6[PubMed] [PMC]
Golde TE, DeKosky ST, Galasko D (2018) Alzheimer’s disease: The right drug, the right time. Science (New York, N.Y.) 362: 1250–1251. https://doi.org/10.1126/science.aau0437
Han HJ, Tokino T, Nakamura Y (1998) CSR, a scavenger receptor-like protein with a protective role against cellular damage caused by UV irradiation and oxidative stress. Human Molecular Genetics 7(6): 1039–1046. https://doi.org/10.1093/hmg/7.6.1039 [PubMed]
Hartmann T (1999) Intracellular biology of Alzheimer’s disease amyloid beta peptide. European Archives of Psychiatry and Clinical Neuroscience 249(6): 291–298. https://doi.org/10.1007/s004060050102 [PubMed]
Jeong H, Shin H, Hong S, Kim Y (2022) Physiological roles of monomeric amyloid-β and implications for Alzheimer’s disease therapeutics. Experimental Neurobiology 31(2): 65–88. https://doi.org/10.5607/en22004 [PubMed] [PMC]
Jones N, Hardy WR, Friese MB, Jorgensen C, Smith MJ, Woody NM, Burden SJ, Pawson T (2007) Analysis of a Shc family adaptor protein, ShcD/Shc4, that associates with muscle-specific kinase. Molecular and Cellular Biology 27(13): 4759–4773. https://doi.org/10.1128/MCB.00184-07 [PubMed] [PMC]
Khaminets A, Heinrich T, Mari M, Grumati P, Huebner AK, Akutsu M, Liebmann L, Stolz A, Nietzsche S, Koch N, Mauthe M, Katona I, Qualmann B, Weis J, Reggiori F, Kurth I, Hübner CA, Dikic I (2015) Regulation of endoplasmic reticulum turnover by selective autophagy. Nature 522(7556): 354–358. https://doi.org/10.1038/nature14498 [PubMed]
Kozin SA, Anashkina AA, Matsuga DG, Suvaan BS, Tumanyan VG, Mitkevich VA, Makarov AA (2025) PepString server as a tool to search for short amino acid subsequences: identification of potential amyloid-beta targets. Acta Naturae 17(3): 67–76. https://doi.org/10.32607/actanaturae.27630 [PubMed] [PMC]
Kurth I, Pamminger T, Hennings JC, Soehendra D, Huebner AK, Rotthier A, Baets J, Senderek J, Topaloglu H, Farrell SA, Nürnberg G, Nürnberg P, De Jonghe P, Gal A, Kaether C, Timmerman V, Hübner CA (2009) Mutations in FAM134B, encoding a newly identified Golgi protein, cause severe sensory and autonomic neuropathy. Nature Genetics 41(11): 1179–1181. https://doi.org/10.1038/ng.464 [PubMed]
Lai LTF, Balaraman J, Zhou F, Matthies D (2023) Cryo-EM structures of human magnesium channel MRS2 reveal gating and regulatory mechanisms. Nature Communications 14: 7207. https://doi.org/10.1038/s41467-023-42599-3 [PubMed] [PMC
Lang DH, Yeung CK, Peter RM, Ibarra C, Gasser R, Itagaki K, Philpot RM, Rettie AE (1998) Isoform specificity of trimethylamine N-oxygenation by human flavin-containing monooxygenase (FMO) and P450 enzymes: selective catalysis by FMO3. Biochemical Pharmacology 56(8): 1005–1012. https://doi.org/10.1016/s0006-2952(98)00218-4[PubMed]
Livingston G, Huntley J, Sommerlad A, Ames D, Ballard C, Banerjee S, Brayne C, Burns A, Cohen-Mansfield J, Cooper C, Costafreda SG, Dias A, Fox N, Gitlin LN, Howard R, Kales HC, Kivimäki M, Larson EB, Ogunniyi A, Orgeta V, Ritchie K, Rockwood K, Sampson EL, Samus Q, Schneider LS, Selbæk G, Teri L, Mukadam N (2020) Dementia prevention, intervention, and care: 2020 report of the Lancet Commission. Lancet (London, England) 396(10248): 413–446. https://doi.org/10.1016/S0140-6736(20)30367-6 [PubMed] [PMC]
Long JM, Holtzman DM (2019) Alzheimer disease: An update on pathobiology and treatment strategies. Cell 179(2): 312–339. https://doi.org/10.1016/j.cell.2019.09.001 [PubMed] [PMC]
Mitkevich VA, Barykin EP, Eremina S, Pani B, Katkova-Zhukotskaya O, Polshakov VI, Adzhubei AA, Kozin SA, Mironov AS, Makarov AA, Nudler E (2023) Zn-dependent β-amyloid aggregation and its reversal by the tetrapeptide HAEE. Aging and Disease 14: 309–318. https://doi.org/10.14336/AD.2022.0827 [PubMed] [PMC]
Pagani L, Eckert A (2011) Amyloid‐Beta interaction with mitochondria. International Journal of Alzheimer’s Disease 2011: 925050. https://doi.org/10.4061/2011/925050 [PubMed] [PMC]
Piskacek M, Zotova L, Zsurka G, Schweyen RJ (2009) Conditional knockdown of hMRS2 results in loss of mitochondrial Mg+ uptake and cell death. Journal of Cellular and Molecular Medicine 13(4): 693–700. https://doi.org/10.1111/j.1582-4934.2008.00328.x [PubMed] [PMC]
Querfurth HW, LaFerla FM (2010) Mechanisms of disease. The New England Journal of Medicine. 362(4): 329–344. https://doi.org/10.1056/NEJMra0909142 [PubMed]
Rawden HC, Kokwaro GO, Ward SA, Edwards G (2000) Relative contribution of cytochromes P-450 and flavin-containing monoxygenases to the metabolism of albendazole by human liver microsomes. British Journal of Clinical Pharmacology 49(4): 313–322. https://doi.org/10.1046/j.1365-2125.2000.00170.x [PubMed] [PMC]
Roher AE, Esh CL, Kokjohn TA, Castaño EM, Van Vickle GD, Kalback WM, Patton RL, Luehrs DC, Daugs ID, Kuo Y-M, Emmerling MR, Soares H, Quinn JF, Kaye J, Connor DJ, Silverberg NB, Adler CH, Seward JD, Beach TG, Sabbagh MN (2009) Amyloid beta peptides in human plasma and tissues and their significance for Alzheimer’s disease. Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association 5(1): 18–29. https://doi.org/10.1016/j.jalz.2008.10.004 [PubMed] [PMC]
Surguchov A, Emamzadeh FN, Titova M, Surguchev AA (2023) Controversial properties of amyloidogenic proteins and peptides: new data in the COVID era. Biomedicines 11(4): 1215. https://doi.org/10.3390/biomedicines11041215 [PubMed] [PMC]
Veeravalli S, Phillips IR, Freire RT, Varshavi D, Everett JR, Shephard EA (2020) Flavin-containing monooxygenase 1 catalyzes the production of taurine from hypotaurine. Drug Metabolism and Disposition 48(5): 378–385. https://doi.org/10.1124/dmd.119.089995[PubMed]
Walker LC (2020) Aβ plaques. Free Neuropathology 1: 31. https://doi.org/10.17879/freeneuropathology-2020-3025 [PubMed] [PMC]
Wang J, Gu BJ, Masters CL, Wang Y-J (2017) A systemic view of Alzheimer disease – insights from amyloid-β metabolism beyond the brain. Nature Reviews. Neurology 13(10): 612–623. https://doi.org/10.1038/nrneurol.2017.111 [PubMed]
Zaru R, Orchard S, UniProt Consortium (2023) UniProt tools: BLAST, align, peptide search, and ID mapping. Current Protocols 3(3): e697. https://doi.org/10.1002/cpz1.697 [PubMed] [PMC]
Zsurka G, Gregán J, Schweyen RJ (2001) The human mitochondrial Mrs2 protein functionally substitutes for its yeast homologue, a candidate magnesium transporter. Genomics 72(2): 158–168. https://doi.org/10.1006/geno.2000.6407 [PubMed]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2025 Anashkina AA, Kozin SA, Korokin MV, Mitkevich VA

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

