Влияние блуждающего нерва и производного индола SS-68 на процессы возбуждения в синоатриальном узле
DOI:
https://doi.org/10.18413/rrpharmacology.9.10054Аннотация
Введение. Фибрилляция предсердий (ФП) – наиболее часто встречающаяся форма сердечных аритмий. Изучение механизмов развития этого патологического процесса позволит более целенаправленно изыскивать новые методы лечения ФП и прогнозировать её возникновение. Цель работы: выявить звенья процесса усвоения синоатриальным узлом центрального ритмогенеза в условиях фибрилляции предсердий при стимуляции блуждающего нерва и применении вещества SS-68.
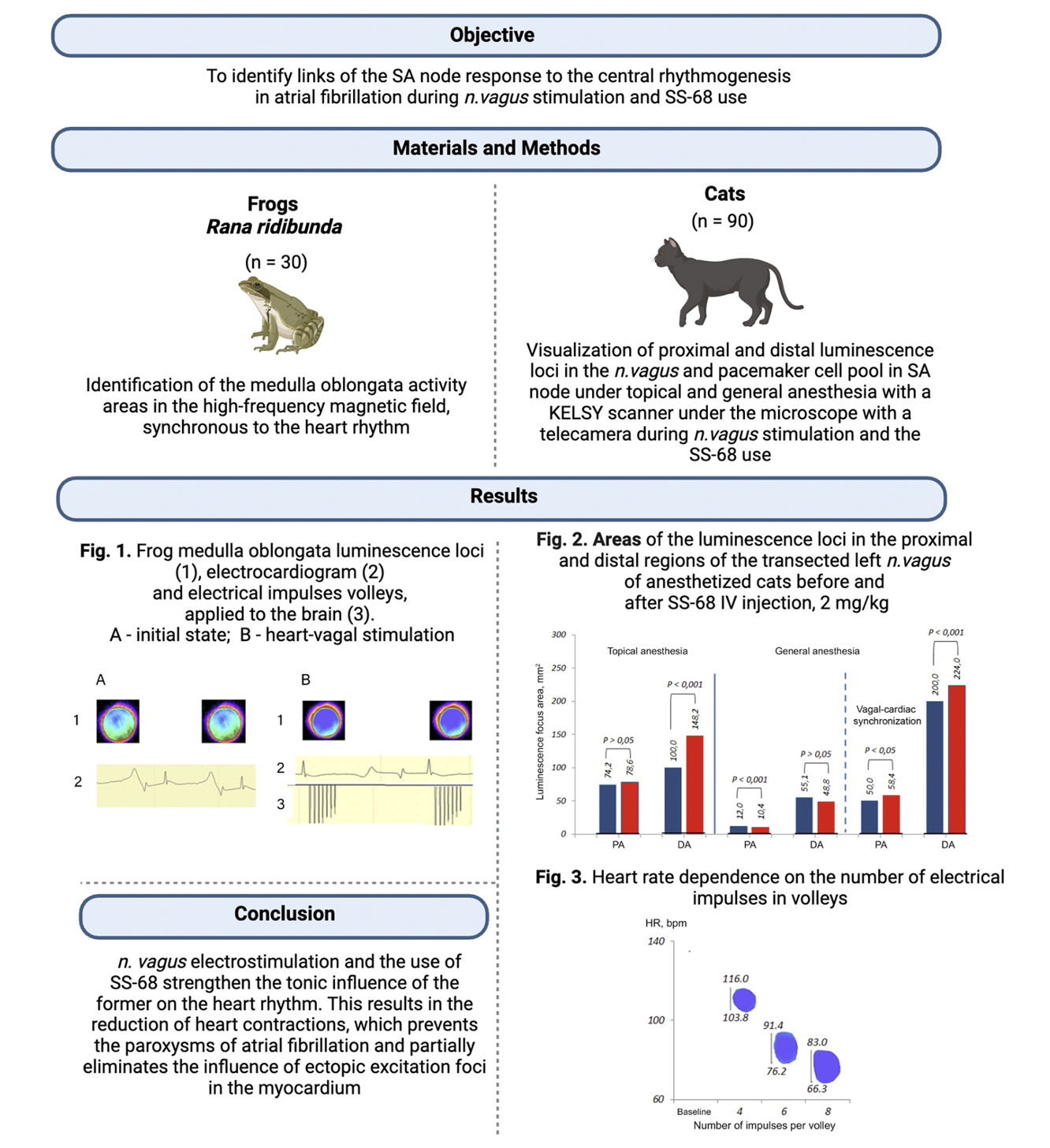
Материал и методы. Опыты проведены на 30 лягушках и 90 кошках. У лягушек в высокочастотном электромагнитном поле определяли активность участков продолговатого мозга, синхронную ритму сердца. У кошек визуализировали проксимальный и дистальный очаги свечения в блуждающем нерве (БН) и пулы пейсмекерных клеток (ПК) в синоатриальном узле в условиях поверхностного и глубокого наркоза при помощи сканера КЕЛСИ под микроскопом телекамерой при стимуляции БН и применении SS-68.
Результаты и их обсуждение.
Стимуляция БН залпами электрических импульсов и введение SS-68 увеличивают очаги свечения в нерве и объединяют пулы ПК. Так, при глубоком наркозе по сравнению с поверхностным площадь проксимального очага свечения БН уменьшалась на 83.8%, а дистального – на 44.9%. На фоне углубленного наркоза площадь проксимального очага свечения при раздражении БН залпами электрических импульсов была больше, чем до раздражения на 76.0%, а дистального – на 72.5%. После введения SS-68 происходило увеличения очагов свечения: в условиях глубокого наркоза по сравнению с поверхностным площадь проксимального очага свечения уменьшалась на 86.8%, а дистального – на 67.1%. При углубленном наркозе площадь проксимального очага свечения в условиях раздражения БН залпами электрических импульсов была больше, чем до раздражения на 82.2%, а дистального – на 78.2%. При одновременном поступлении сигналов из мозга через БН к пулам ПК последние усваивается ими, очаг ранней деполяризации становится широким, что предотвращает развитие ФП. Повышение синхронизирующего влияния БН, может явиться одним из способов лечения ФП вегетативного генеза, а в случае уменьшения его влияния – прогностическим фактором возникновения рецидива ФП.
Заключение. Тоническое влияние БН на ритм сердца при электростимуляции первого и применении SS-68 проявляется урежением сердечных сокращений: разницей между исходным ритмом сердца и минимальной границей диапазона синхронизации, имеющей корреляционную связь. Урежение сердечного ритма под влиянием БН предотвращает пароксизмы ФП, но полностью не устраняет влияние на неё эктопических очагов.
Графическая аннотация
Ключевые слова:
вещество SS-68, пейсмекерные клетки, синоатриальный узел, ритм мозга, пейсмекерные клетки, синоатриальный узел, ритм мозгаБиблиографические ссылки
Abramochkin DV, Sukhova GS, Rozenshtraukh LV (2009) Mechanisms of functioning and regulation of the sinoatrial node in mammals. Advances in Physiological Sciences [Uspekhi Fiziologicheskikh Nauk] 40(4): 21–41. [in Russian]
Ardell JL (2011) The cardiac neuronal hierarchy and susceptibility to arrhythmias. Heart Rhythm 8: 590–591. http://doi.org/10.1016/j.hrthm.2010.12.019 [PubMed] [PMC]
Baruscotti M, Robinson RB (2007) Electrophysiology and pacemaker function of the developing sinoatrial node. The American Journal of Physiology: Heart and Circulatory Physiology 293(5): 2613–2623. https://doi.org/10.1152/ajpheart.00750.2007. [PubMed]
Bradd AD, Al Abed A, Guo T, Lovell NH, Dokos S (2012) Study of cardiac pacemaker excitation using generic ionic models and realistic cell distribution. Annual International Conference of the IEEE Engineering in Medicine and Biology Society 2012: 195–198. https://doi.org/10.1109/EMBC.2012.6345904 [PubMed]
Brotman DJ, Golden SH, Wittstein IS (2007) The cardiovascular toll of stress. Lancet 370(9592): 1089–1100. http://doi.org/10.1016/S0140-6736(07)61305-1 [PubMed]
Chen PS, Chen LS, Fishbein MC, Lin SF, Nattel S (2014) Role of the autonomic nervous system in atrial fibrillation: pathophysiology and therapy. Circulation Research 114(9): 1500–1515. http://doi.org/10.1161/CIRCRESAHA.114.303772 [PubMed] [PMС]
Chen PS, Tan AY (2007) Autonomic nerve activity and atrial fibrillation. Heart Rhythm 4: S61–S64. http://doi.org/10.1016/j.hrthm.2006.12.006 [PubMed] [PMC]
Chernyavsky AM, Rakhmonov SS, Pak IA, Kareva YuE (2013) The role of the autonomic nervous system in the development of atrial fibrillation. Clinical Medicine [Klinicheskaya Meditsina] 91(1): 16–20. [in Russian]
Filatov AG, Tarashvili EG (2012) Epidemiology and social significance of atrial fibrillation. Annals of Arrhythmology [Annaly Aritmologii] 2: 5–14. [in Russian]
Filyukova MV (2018) Sinus node dysfunction. Journal of Basic Medicine and Biology [Zhurnal Fundamental’nou Meditsiny i Biologii] 1: 11–19. [in Russian]
Galenko-Yaroshevsky PA, Alekseenko SN, Kanorsky SG, Bogus S, Dukhanin AS, Vasiliev PM, Galenko-Yaroshevsky AP, Pavlyuchenko II, Lebedeva SA, Nadein KA, Nechepurenko AA, Suzdalev KF, Zelenskaya AV, Uvarov AV (2023) Atrial fibrillation. Status of the problem and prospects for creating a new antifibrillator agent based on indole amino derivatives. Prosveshchenie-Yug, Krasnodar, 747 pp. [in Russian]
Garg PK, O'Neal WT, Diez‐Roux AV, Alonso A, Soliman EZ, Heckbert S (2019) Negative affect and risk of atrial fibrillation. MESA. Journal of American Heart Association 8(1): e01060. http://doi.org/10.1161/JAHA.118.010603[PubMed] [PMC]
Grigoriev MG, Babich LN (2015) Model of excitation of pacemaker cardiomyocytes of the cardiac conduction system. Young Scientist [Molodoi Ucheny] 10(90): 178–184. [in Russian]
Karemaker JM (2015) How the vagus nerve produces beat-to-beat heart rate variability; experiments in rabbits to mimic in vivo vagal patterns. Journal Clinical of Translational Research 1(3): 190–204. [PubMed] [PMC]
Legallois D, Gomes S, Pellissier A, Milliez P (2013) Medical emotional stress-induced atrial fibrillation: My own personal experience. International Journal of Cardiology 167(6): 182–183. http://doi.org/10.1016/j.ijcard.2013.04.074[PubMed]
Linz D, Ukena C, Mahfoud F, Neuberger HR, Böhm M (2014) Atrial autonomic innervation: a target for interventional antiarrhythmic therapy. Journal of the American College Cardiology 63(3): 215–224. http://doi.org/10.1016/j.jacc.2013.09.020 [PubMed]
Lorincz I, Szabó Z, Simkó J, Szánthó E, Barta K, Füzi M, Szigeti G. (2008) Atrial fibrillation and the autonomous nervous system. Orvosi Hetilap 149(43): 2019–2028. http://doi.org/10.1556/OH.2008.28466 [PubMed] [in Hungarian]
Mazurov ME (2006) Rhythmogenesis in the sinoatrial unit of the heart. Biofizika 51(6): 1092–1099. [PubMed]
Mazurov ME (2009) Control of the unified heart rhythm. Biofizika 54(1): 89-96. [PubMed]
Mironova TF, Mironov VA, Obukhova TYu, Shmonina OG, Mordas EYu, Kudrina KS, Milovankina NO, Milashchenko AI (2018) Autonomic regulation of heart rate (review). Ural Medical Journal [Ural’sky Meditsinsky Zhurnal] 10(165): 90–105. [in Russian]
Murphy C, Lazzara R (2016) Current concepts of anatomy and electrophysiology of the sinus node. Journal of Interventional Cardiac Electrophysiology 46(1): 9–18. https://doi.org/10.1007/s10840-016-0137-2. [PubMed]
Nechepurenko AA, Romantsov EI (2020) The influence of the vagus nerve on the duration of paroxysmal atrial fibrillation and the zone of early depolarization in the sinoatrial region of the heart. In: Higher School: Scientific Research. Proceedings of the Interuniversity Scientific Congress, Moscow, Russia, February 19, 2020. Infinity Publishing House, Ufa, p. 136–143. [in Russian]
Pokrovsky VM (2007) Formation of heart rhythm in humans and animals. Kuban-kniga Publishing House, Krasnodar, 143 pp. [in Russian]
Pokrovsky VM, Nechepurenko AA, Tarasov DG, Korotkov KG, Abushkevich VG (2019) Sinoatrial node pacemaker cells pool Dynamics upon synchronization with vagus nerve rhythm. Journal of Applied Biotechnology and Bioengineering 6(3): 114–116. https://doi.org/10.15406/jabb.2019.06.00182
Pokrovsky VM, Tarasov DG, Nechepurenko AA, Korotkov KG, Abushkevich VG (2018) The focus of early depolarization of the sinoatrial region of the right atrium in humans before anesthesia and during anesthesia. Clinical and Experimental Surgery [Klinicheskaya n Eksperimental’naya Khirurgiya]. Journal named after academician BV Petrovsky 6(4 (22)): 49–54. https://doi.org/10.24411/2308-1198-2018-14007 [in Russian]
Svensson T, Kitlinski M, Engström G, Melander O (2017) Psychological stress and risk of incident atrial fibrillation in men and women with known atrial fibrillation genetic risk scores. Scientific Reports 7: 42613. http://doi.org/10.1038/srep42613 [PubMed] [PMC]
Van Weerd JH, Christoffels VM (2016) The formation and function of the cardiac conduction system. Development 143: 197210. https://doi.org/10.1242/dev.124883 [PubMed]
Vislobokov AI, Bogus SK, Ignatov YuD, Galenko-Yaroshevsky PA, Melnikov KN (2012) Comparative membranotropic activity of indole derivative SS-68 and amiodarone on mollusk neurons. New Technologies [Novye Tekhnologii] 4: 283–290. [in Russian]
Yaniv Y, Ahmet I, Liu J, Lyashkov AE, Guiriba T, Okamoto Y, Ziman BD, Lakatta EG (2014) Synchronization of sinoatrial node pacemaker cell clocks and its autonomic modulation impart complexity to heart beating intervals. Heart Rhythm 11(7): 1210–1219. http://doi.org/10.1016/j.hrthm.2014.03.049 [PubMed] [PMC]
Yaniv Y, Lyashkov AE, Lakatta EG (2014a) Impaired signaling intrinsic to sinoatrial node pacemaker cells affects heart rate variability during cardiac disease. Journal Clinical of Trials 4(1): 152. http://doi.org/10.4172/2167-0870.1000152. [PubMed] [PMC]
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2023 Anatoliy A. Nechepurenko, Pavel A. Galenko-Yaroshevsky, Vladimir M. Pokrovskiy, Anait V. Zelenskaya, Konstantin F. Suzdalev, Svetlana A. Lebedeva, Natalia M. Makhnova, Alexandr V. Maksemyuk, Ivan A. Minenko, Roman V. Nikitin, Valeriy G. Abushkevich†

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

