Идентификация и синтез метаболитов нового противоглаукомного препарата
DOI:
https://doi.org/10.18413/rrpharmacology.10.431Аннотация
Актуальность: Определение продуктов биотрансформации является обязательной частью доклинического изучения оригинальных лекарственных средств. Для нового препарата 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида данных исследований ранее не проводилось. Идентификация и синтез субстанций метаболитов необходимы для последующих испытаний биодоступности, линейности фармакокинетики, кумуляции, распределения и экскреции.
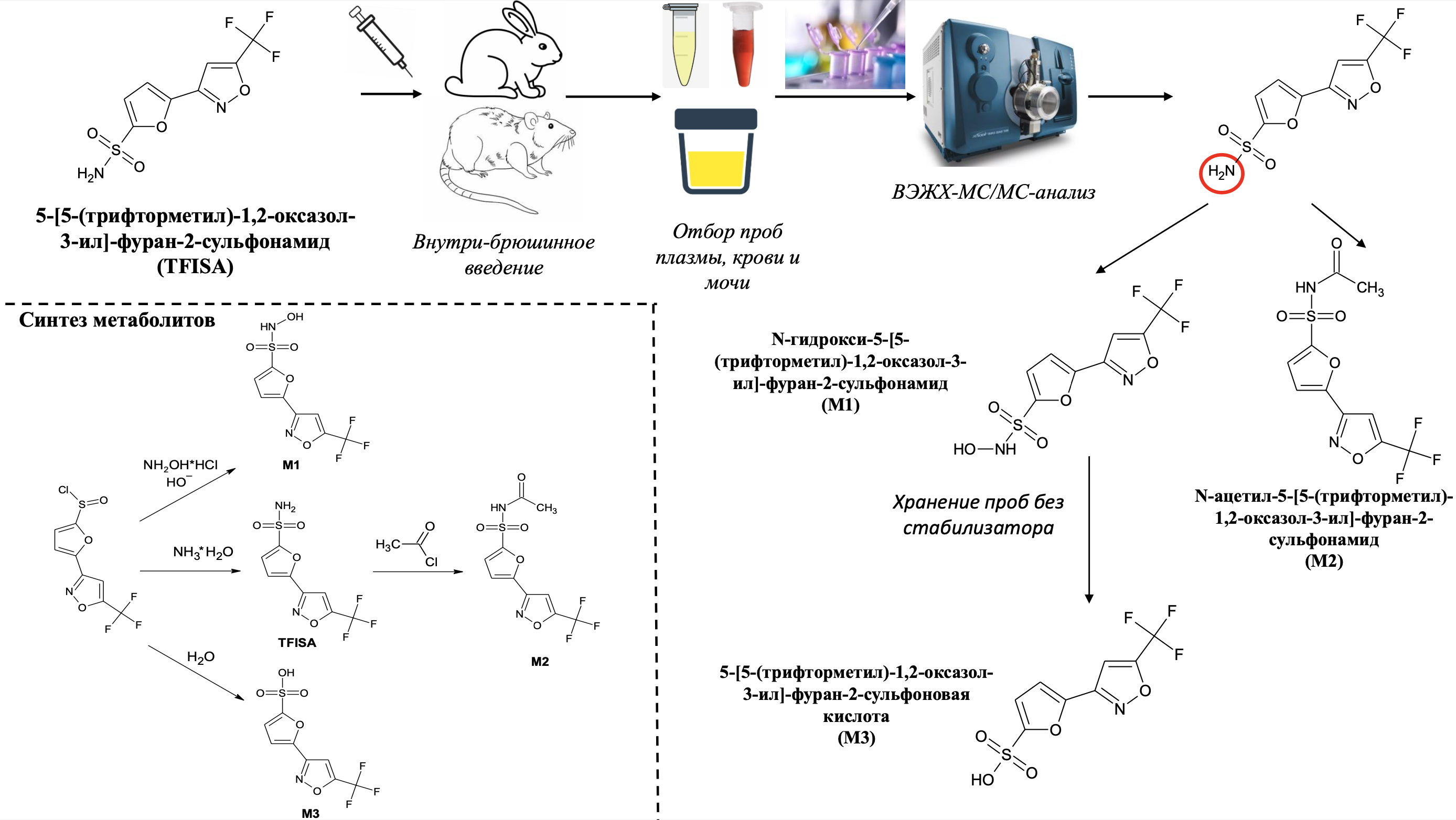
Материалы и методы: Исследование проводилось на крысах линии Wistar и кроликах породы Советская шиншилла. Субстанция изучаемого препарата вводилась животным внутрибрюшинно. Забор образцов крови животных осуществлялся до введения и через 1 ч, 2 ч, 4 ч, 24 ч после введения в пробирки с К3ЭДТА. Часть каждого образца центрифугировалась для отделения плазмы. Пробы мочи крыс были отобраны до введения и в промежутки 0-2 ч, 2 - 4 ч, 4-6 ч, 6-24 ч после введения препарата. Метод ВЭЖХ-МС/МС применяли для идентификации метаболитов в биологических жидкостях. После предварительного анализа субстанции предполагаемых продуктов биотрансформации были синтезированы. Структура полученных субстанции подтверждалась методами ЯМР-спектроскопии и масс-спектрометрии высокого разрешения. Затем с помощью ВЭЖХ-МС/МС проводилось сравнение с идентифицированными в биологических жидкостях веществами по времени удерживания, соотношениям площадей хроматографических пиков на основных MRM-переходах.
Результаты и обсуждение: При анализе образцов плазмы и крови обнаружен метаболит, образовавшийся путём присоединения атома кислорода к молекуле препарата, а также ацилированный метаболит. В моче крыс также присутствовало соединение с увеличенной на 1 дальтон молекулярной массой по сравнению с лекарственным веществом. Были синтезированы N-гидрокси-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид, 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфононовая кислота, которые потенциально могли быть получены в процессе биотрансформации, а также N-ацетил-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамид. Повторные ВЭЖХ-МС/МС-испытания подтвердили правильность начальной гипотезы. Установлено, что производное сульфоновой кислоты образуется в моче в результате разложения N-гидроксиметаболита в процессе забора и хранения образцов.
Вывод: Изучаемый препарат метаболизируется с образованием двух метаболитов: N-гидрокси-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида и N-ацетил-5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфонамида. N-гидроксиметаболит способен разлагаться в образцах биологических жидкостей с образованием 5-[5-(трифторметил)-1,2-оксазол-3-ил]-фуран-2-сульфононовой кислоты.
Графическая аннотация
Ключевые слова:
биотрансформация, селективный ингибитор карбоангидразы II, ВЭЖХ-МС/МС, N-гидроксисульфонамид, N-ацетилсульфонамид, сульфонамидБиблиографические ссылки
Alseekh S , Aharoni A, Brotman Y, Contrepois K, D’Auria J, Ewald J (2021) Mass spectrometry-based metabolomics: a guide for annotation, quantification and best reporting practices. Nature Methods 18(7): 747–756. https://doi.org/10.1038/s41592-021-01197-1
Begou O, Drabert K, Theodoridis G, Tsikas D (2020) GC-NICI-MS analysis of acetazolamide and other sulfonamide (R-SO2-NH2) drugs as pentafluorobenzyl derivatives [R-SO2-N(PFB)2] and quantification of pharmacological acetazolamide in human urine. Journal of Pharmaceutical Analysis 10(1): 49–59. https://doi.org/10.1016/j.jpha.2019.11.006
Dhandar AG, Chaudhari SR, Ganorkar SB, Patil AS, Surana SJ (2022) Mini-review on bioanalytical estimation of brinzolamide. Current Pharmaceutical Analysis 18(3): 265–272. https://doi.org/10.2174/1573412917666210812103414
Ferraroni M, Lucarini L, Masini E, Korsakov M, Scozzafava A, Supuran CT, Krasavin M (2017) 1,3-Oxazole-based selective picomolar inhibitors of cytosolic human carbonic anhydrase II alleviate ocular hypertension in rabbits: Potency is supported by X-ray crystallography of two leads. Bioorganic & Medicinal Chemistry 25 (17): 4560–4565. https://doi.prg/10.1016/j.bmc.2017.06.054 [PubMed]
1.2.1.1.0008.15 «The mass-spectrometry» (2023) The State Pharmacopoeia of Russian Federation. XV edition https://pharmacopoeia.regmed.ru/pharmacopoeia/izdanie-15/
1.2.1.2.0001.15 «The Chromatography» (2023) The State Pharmacopoeia of Russian Federation. XV edition https://pharmacopoeia.regmed.ru/pharmacopoeia/izdanie-15/
Khokhlov AL (ed.), Pyatigorskaya NV (ed.) (2019) Industrial Pharmacy: The Way to Create a Product. The Russian Scientific Academy, Moscow, 394 pр. ISBN: 978-5-907036-57-4.
Khokhlov AL, Shetnev AA, Korsakov MK, Fedorov VN, Tyushina AN, Volkhin NN, Vdovichenko VP (2023) Pharmacological properties of sulfonamide derivatives – new inhibitors of carbonic anhydrase. Bulletin of Experimental Biology and Medicine 175 (2): 166–170. https://doi.org/10.47056/0365-9615-2023-175-2-166-170
Khokhlov AL, Yaichkov II, Korsakov MK, Shetnev AA, Volkhin NN, Petukhov SS (2023) Development of quantification methods of a new selective carbonic anhydrase II inhibitor in plasma and blood and study of the pharmacokinetics of its ophthalmic suspension in rats. Research Results in Pharmacology 9(4): 53–64. https://doi.org/10.18413/rrpharmacology.9.10056
Lo Faro AF, Tini A, Gottardi M, Pirani F, Sirignano A, Giorgetti R, Busardò FP (2021) Development and validation of a fast ultra-high-performance liquid chromatography tandem mass spectrometry method for determining carbonic anhydrase inhibitors and their metabolites in urine and hair. Drug Testing and Analysis 13(8): 1552–1560. https://doi.org/10.1002/dta.3055 [PubMed] [PMC]
Ma Y, Modrzynski JJ, Yang Y, Aamand J, Zheng Y (2021) Redox-dependent biotransformation of sulfonamide antibiotics exceeds sorption and mineralization: Evidence from incubation of sediments from a reclaimed water-affected river. Water Research 205: 117616. https://doi.org/10.1016/j.watres.2021.117616
Mironov AN (ed.) (2012) Guidelines for Conducting Preclinical Studies of Medicines. Volume 1. Polygraph Plus, Moscow, 944 pp.
Reddy GN, Laltanpuii C, Sonti R (2021) Review on in vivo profiling of drug metabolites with LC-MS/MS in the past decade. Bioanalysis 13(22): 1697–1722. https://doi.org/10.4155/bio-2021-0144
Sibinčić N, Kalinin S, Sharoyko V, Efimova J, Gasilina OA, Korsakov M et al (2023) A series of trifluoromethylisoxazolyl- and trifluoromethylpyrazolyl-substituted (Hetero) aromatic sulfonamide carbonic anhydrase inhibitors: Synthesis, and convenient prioritization workflow for further in vivo studies. Medicinal Chemistry 19(2): 193–210. https://doi.org/10.2174/1573406418666220831112049
Vree TB, Hekster YA, Tijhuis MW (1985) Metabolism of sulfonamides. Antibiotics and Chemotherapy. Pharmacokinetics of Sulfonamides Revisited 34: 5–65. https://doi.org/https://doi.org/10.1159/000410271
Загрузки
Опубликован
Как цитировать
Выпуск
Раздел
Лицензия
Copyright (c) 2024 Alexander L. Khokhlov, Ilya I. Yaichkov, Mikhail K. Korsakov, Anton A. Shetnev, Sergey A. Ivanovskiy, Mikhail A. Alexeev, Olga A. Gasilina, Nikita N. Volkhin, Sergey S. Petukhov

Это произведение доступно по лицензии Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
 Русский
Русский
 English
English

